■ 주요용어 정리
펩타이드결합(peptide bond)
: 단백질을 구성하는 아미노산과 아미노산의 결합형태로 앞의 아미노산의 카르복실기와 뒤의
아미노산의 아미노기와의 결합
변성(denaturation)
: 산, 염기, 열, 자외선 등으로 인하여 단백질의 황이나 산의 이중결합이 풀어짐으로써 3차원의 단백질이 선
형으로 변화되는 현상
등전위점(Isoeletric point, pI)
: 단백질의 전하가 0이 되는 pH로 단백질의 아미노산 조성에 의해 달라짐
함황아미노산
: 화학구조에 황을 함유하는 아미노산으로 메치오닌과 시스틴 등이 있음
필수아미노산
: 사료의 형태로 공급되어야 하는 아미노산
구상단백질
: 폴리펩티드 사슬이 적당히 구부러져 공모양을 지니는 단백질로, 가열하면 응고하거나 변성되며, 용해성과
반응성이 있음
1. 단백질의 특성
- 탄소, 수소, 산소, 질소 및 황으로 구성
- 아미노산이 펩타이드 결합(peptide bond)으로 연결된
고분자 화합물
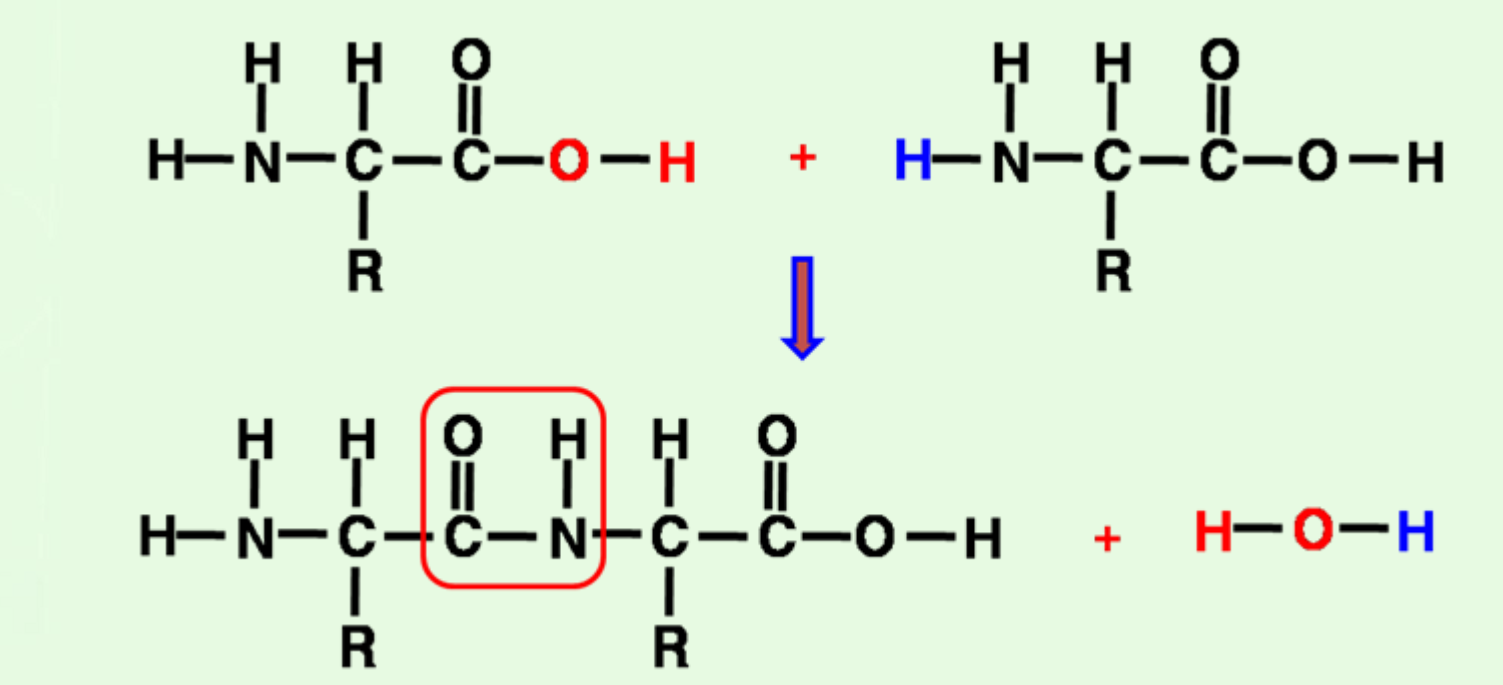
- 가수분해되어 아미노산 생성
- 산과 염기가 결합된 상태(Zwitterionic form)로 생리적인
상태에서는 carboxyl기와 amine기가 이온화 됨
- 생명체의 기본 구성물질: 세포, 효소, 호르몬, 면역체
- 유기용매, 산, 염 등에 의해 응고(변성, denaturation)됨
1) 단백질의 구조
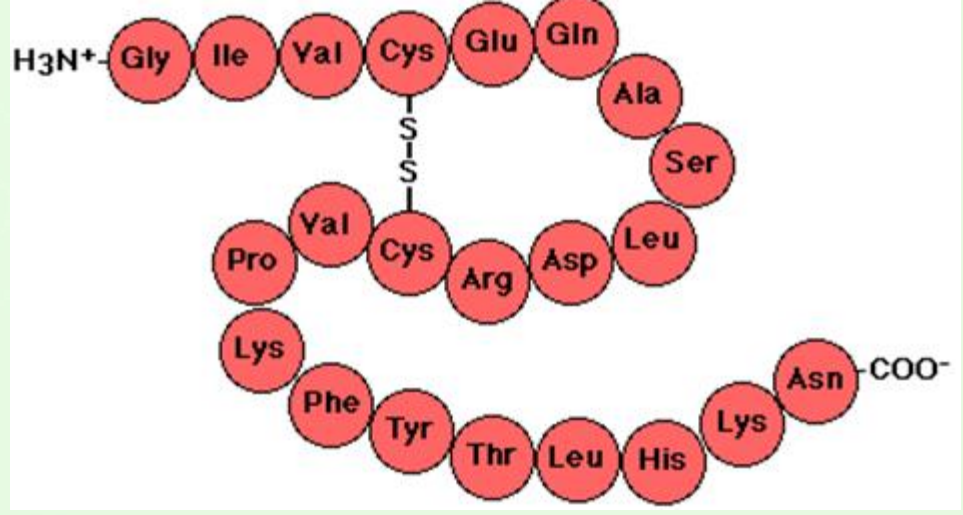
1차 구조(Primary Structure)
- 1˚ structure
- 아미노산의 서열
- 단백질의 유젂정보 및 특징 분석에 이용
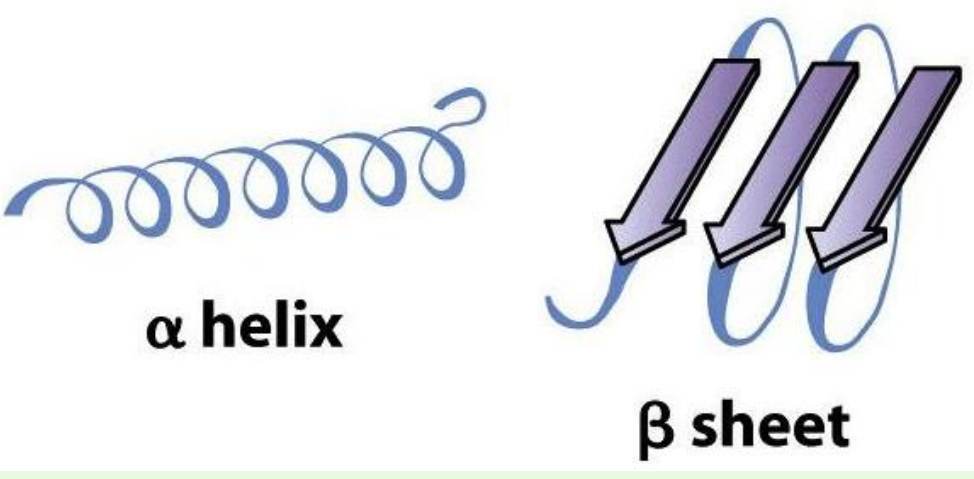
2차 구조(Secondary Structure)
- 2˚ structure
- 탄소골격의 배치
- α-helix(나선형)와 β-sheet(판형)
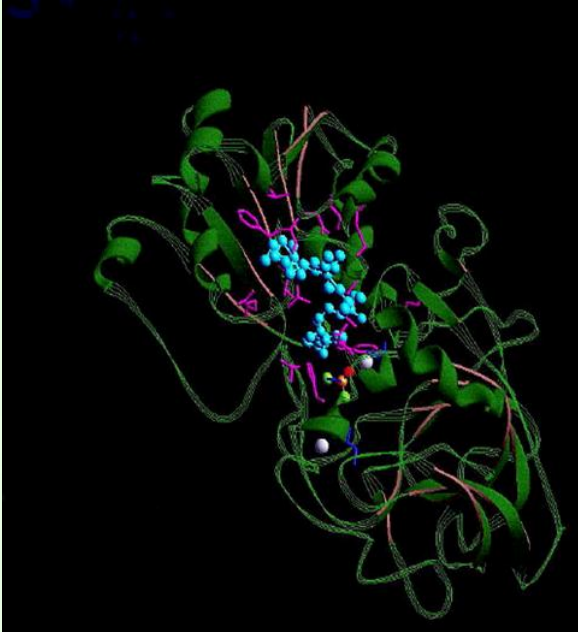
3차 구조(Tertiary Structure)
- 3˚ structure
- 단백질의 입체구조(3차원적 구조)
- 단백질의 기능에 영향
4차 구조(Quaternary Structure)
- 4˚ structure
- Subunit(기능성 잔기) 간의 배치
2. 아미노산의 특성과 종류
1) 아미노산의 특성
- 수용성이며 공유결합 화합물
- 탄소수가 적은 지방산의 유도체
- 산과 염기가 결합된 양성 물질
- 고유의 등전위점(Isoelectric point, pI)
2) 아미노산의 종류
Monoamino-monocarboxylic amino acid
Monoamino-dicarboxylic amino acid
Diamino-monocarboxylic amino acid
Triamino-monocarboxylic amino acid
Sulfur containing amino acid
Aromatic amino acid
Heterocyclic amino acid
3) Monoamino-Monocarboxylic
- 의미: 아미노기 1 개 + 카르복식기 1 개: 7 종류
글리신(glycine, Gly, G)
- 가장 간단한 아미노산
- 폴피린(phorphyrin), 퓨린(purine), 혈색소 합성에 이용
알라닌(Alanine, Ala, A)
- 글루탐산(glutamic acid) 생성에 관여
- 피루브산(pyruvate)로 전환되어 TCA 회로에서 에너지 생성에 이용
발린(Valine, Val, V)
- 체내 질소평형에 관여하는 필수아미노산
루이신(Leucine, Leu, L)
- 필수아미노산
이소루이신(Isoleucine, Ile, I)
- 필수아미노산
세린(Serine, Ser, S)
- 효소의 활력에 관여
트레오닌(Threonine, Thr, T)
- 글리신과 젖산으로 분해
4) Monoamino-Dicarboxylic
의미: 아미노기 1 개, 카르복실기 2개
아스파르트산(Aspartic acid, Asp, D)
- TCA 회로 및 오르니틴(orinitine)회로에 관여
글루탐산 (Glutamic acid, Glu, E)
- GTP의 구성물질
5) Diamino-Monocarboxylic
의미: 아미노기 2 개, 카르복실기 1개
리신(Lysine, Lys, K)
- 히스톤 및 알부민 합성에 관여하는 필수아미노산
6) Triamino-Monocarboxylic
의미: 아미노기 3 개, 카르복실기 1개
아르기닌(Arginine, Arg, R)
- 요소회로의 구성성분인 필수아미노산
7) Sulfur Containing
의미: 황(S, sulfur)이 함유된 아미노산
시스테인(Cysteine, Cys, C)
- 필수아미노산
메치오닌(Methionine, Met, M)
- 단백질 합성에 첫 번째로 이용되는 필수아미노산
8) Aromatic
* 의미: 벤젠고리가 함유된 아미노산
* 페닐알라닌(Phenylalanine, Phe, F)
- 필수아미노산
타이로신(Tyrosine, Tyr, Y)
- 티록신, 카테콜라민의 합성에 이용
9) Heterocyclic
의미: 부정형의 고리가 함유된 아미노산
트립토판(Tryptophan, Trp, W)
- 필수아미노산
프롤린(Proline, Pro, P)
- 콜라겐에 많이 함유되어 있는 아미노산
10) 필수아미노산
* 정의: 체내에서 합성되지 않거나, 합성되어도 그 양이
부족하여 사료의 형태로 반드시 공급되어야 하는 아미노산
* 이유: 체내에서 탄소골격이 합성되지 않기 때문에
아미노기 전환(transamination) 과정을 통하여 아미노산이
합성되지 않기 때문
* 종류: 아르기닌, 히스티딘, 이소루신, 루신, 리신, 메치오닌
페닐알라닌, 트레오닌, 트립토판, 발린
3. 단백질의 종류 및 특징
1) 단순단백질(Simple Protein)
정의: 아미노산 만으로 구성된 단백질
구분: 구형단백질과 선형단백질로 구분
선형단백질(Fibrous Protein)
특징
- 동물의 체내에서 구조적 기능 수행
- 소화효소에 의해 쉽게 분해도지 않음
콜라겐(collagen): 동물의 결체조직의 주성분
엘라스틴(elastin): 건(tendon), 혈관과 같이 싞축성이 있는
조직의 주성분
케라틴(keratin): α-케라틴(털, 모발)
β- 케라틴(깃, 피부, 부리, 각질)
구형단백질(Globular Protein)
특징
- Polypeptide chain이 구형을 형성
- 기능성 단백질의 주성분
알부민(Albumin): 수용성 / 열에 응고
혈액, 젖, 알
히스톤(Histone): 세포의 핵에 졲재
염용액에 용해되나 열에 응고 안됨
알지닌과 라이신(lysine)으로 가수분해 됨
프로타민(Protamine): 척추동물의 정자의 주성분
핵산과 결합하여 존재
글로불린(Globulin): 젖, 난, 혈액에 존재하는 저장성 단백질
2) 복합단백질(Conjugated Protein)
정의: 아미노산과 비단백질성 물질로 구성된 단백질
* 당단백질(Glycoprotein)
- 점막의 형태로 분비되어 윤활작용 수행
- 난백의 저장성 단백질
- 종류: glucosamine, galactosamine
* 지방단백질(Lipoprotein)
- 세포막의 주요 성분
- 혈액의 지방이 세포 내로 유입되는 형태
* 인단백질(Phosphoprotein)
- 인산기를 함유하는 단백질
- 카세인, 난황의 포스비틴(posvitin)
* 색소단백질(Chromoprotein)
- 단백질과 세포가 결합핚 형태
- 헤모글로빈(Haemoglobin), 시토크롬(Cytochrome)
3) 기타 단백질
* 유도단백질(Derivetized Protein)
- 1차 유도체: 변성단백질
- 2차 유도체: 단백질 가수분해 산물
* 핵산(Nucleic Acid)
- 유전정보의 저자
- 피리미딘 계열: 시토신, 티민, 우라실
- 퓨린 계열: 아데닌, 구아닌
4) 단백질의 기능
- 세포의 구성성분
- 항체의 주성분
- 효소 및 호르몬의 구성성분
- 유전현상에 관여
- 물질의 운반
- 영양소의 저장기능
■ 연습문제
1. 다음의 그림에서 peptide bond의 위치는 어디인가?
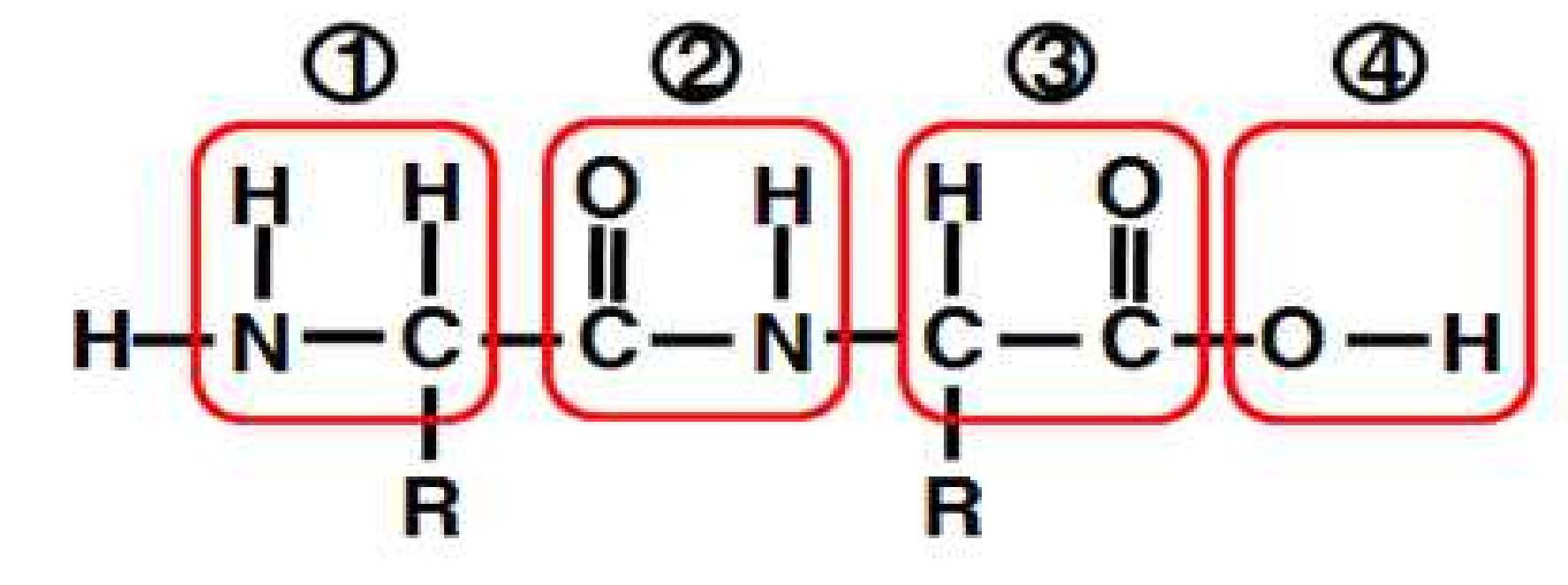
① 1번위치
② 2번위치
③ 3번위치
④ 4번위치
정답 : ②
해설 : Peptide bond는 carboxyl group의 C=O와 amine group의 N이 결합되어
아미노산이 연결되는 결합이다.
2. 단백질의 구조 중 α-helix나 β-sheet 등을 구성하는 구조는?
① 1차구조
② 2차구조
③ 3차구조
④ 4차구조
정답 : ②
해설 : 단백질의 2차구조는 탄소골격의 배치를 나타내는 것으로 α-helix나 β-sheet
등으로 되어있다.
3. 아미노산 중 피루브산을 전환되어 TCA 회로에서 에너지 생성에 이용될 수 있는
monoamino-monocarboxylic amino acid는?
① 글리신(glycine)
② 알라닌(alanine)
③ 발린(valine)
④ 루이신(leucine)
정답 : ②
해설 : 알라닌은 피루브산을 전환되어 TCA 회로에서 에너지 생성에 이용될 수 있다.
4. 단백질의 합성에 첫 번째로 이용되는 필수아미노산은?
① 메치오닌(methionine)
② 트립토판(tryptophan)
③ 프롤린(proline)
④ 스테인(cysteine)
정답 : ①
해설 : 단백질 합성의 개시코돈은 일반적으로 메치오닌을 의미하여, 단백질 합성의 첫번째 아미노산이다.
5. 다음의 단백질 중 선형단백질은?
① 알부민
② 히스톤
③ 글로블린
④ 콜라겐
정답 : ④
해설 : 콜라겐, 엘라스틴, 케라틴 등은 선형단백질이고, 알부민, 히스톤, 글로블린, 포
스타민 등은 구형단백질이다.
■ 핵심요약 정리
▪ 단백질의 탄소, 수소, 산소, 질소 및 황으로 구성된 유기물로 구성된 아미노산의 펩타이드 결합으로 형성되며, 세포의 구성 및 기능에 중요한 역할을 담당한다.
▪ 단백질은 아미노산의 배열인 1차구조, 나선형의 2차구조 및 황 이중결합에 의한 3차구조를 형성하고 있으며, 4차구조는 기능성 잔기의 배치를 의미한다.
▪ 단백질의 구성하는 아미노산의 종류에는 지방족, 방향족, 함황, 산성, 염기성 및 이상환상의 아미노산이 있으며, 이들의 배열에 따라 단백질의 성질 및 기능이 다르다. 필수아미노산이란 체내에서 합성되지 않거나, 합성되어도 그 양이 부족하여 사료의 형태로 반드시 공급되어야 하는 아미노산을 말한다. 필수아미노산에는 아
르기나, 히스티딘, 이소루신, 루신, 리신, 메치오닌, 페닐알라닌, 트레오닌, 트립토판 및 발린 등이 있다.
▪ 단백질은 아미노산만으로 구성된 단순단백질과 아미노산과 비단백질성 물질로 구성된 복합단백질이 있다. 단순단백질은 구상단백질과 섬유상단백질로 분류할 수있으며, 구상단백질은 알부민, 글로불린, 효소등과 같은 단백질로 용해성과 반응성이 있는 단백질이다. 섬유상단백질은 케라틴, 젤라틴, 콜라겐, 미오신, 피브로인 등
과 같이 긴 섬유모양으로 된 폴리펩티드 사슬이 일정한 방향으로 규칙적으로 배열되어 섬유상을 지니는 가수분해가 어려운 단백질이다. 복합단백질에는 아미노산과 당의 결합체인 당단백질, 아미노산과 지방이 결합한 지방단백질, 인산기를 함유하는 인단백질 및 색소를 함유하고 있는 색소단백질 등이 있다.
'방통대 - 가축영양학' 카테고리의 다른 글
| 방송통신대학교 - 농학과 - 가축영양학 핵심 요약정리 - 7 비타민 (12) | 2021.01.02 |
|---|---|
| 방송통신대학교 - 농학과 - 가축영양학 핵심 요약정리 - 6 대사작용 (1) | 2021.01.02 |
| 방송통신대학교 - 농학과 - 가축영양학 핵심 요약정리 - 4 탄수화물과 지방 (1) | 2020.12.31 |
| 방송통신대학교 - 농학과 - 가축영양학 핵심 요약정리 - 3 소화와 흡수 (2) | 2020.12.30 |
| 방송통신대학교 - 농학과 - 가축영양학 핵심 요약정리 - 2 소화및 흡수 (0) | 2020.12.29 |