2강. 물
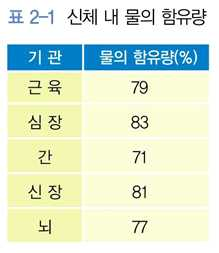
⋅세포의 주성분으로 약 70~85% 차지함
⋅분자 구조에 의한 독특한 성질을 가짐
물의 역할
⋅대사 반응의 용매로 작용함
⋅세포가 일정한 온도와 pH를 유지하도록 작용함
⋅생화학 반응에서 직접 반응물로 작용함 (예: 소화 작용)

1. 물의 분자 구조 ⋅물(H2O):한 개의 산소원자와 두 개의 수소 원자가 결합된 형태
⋅H-O-H 결합각은 104.5°
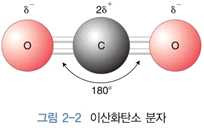
1) 물의 극성 공유결합 ⋅산소와 수소 사이의 결합 → 공유결합 (극성)
- 전기음성도 : 산소 > 수소 따라서 산소 δ-, 수소 δ+를 가짐
⋅쌍극자 모멘트 : 산소분자의 구부러진 구조 특징 때문
- 이산화탄소의 경우 O=C=O 형태이므로 물과 달리 직선상으로 배치 → 비극성 성질을 띰

2) 물의 수소결합 ⋅수소결합 : 인접 물 분자와의 결합
- 한 물 분자의 산소와 인접한 물 분자의 수소 사이의 끌림
- 핵산, 단백질 등 다수 생체 분자에서도 나타남(수소 -O, N, S)
⋅결합에너지 : 비공유결합물 간 결합 < 수소결합 < 공유결합
- 수소결합 : 0.5~10 kcal/mol
- 공유결합 : 60~120 kcal/mol
- 결합에너지: 결합을 끊는데 필요한 에너지


2. 물의 특성
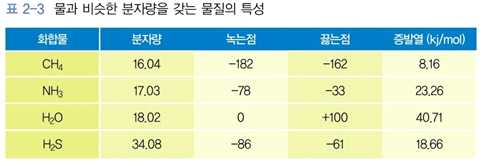
1) 물의 일반적인 특성
⋅수소결합을 하므로 분자량이 비슷한 다른 분자들보다 끓는점, 녹는점, 증발열, 열용량이 높음
(타 분자는 상온에서 기체)
- 한 분자의 물 → 4개의 물 분자와 수소결합
- 결합을 끊는데 많은 에너지가 필요함
- 액체 상태로 존재 → 생물체에서 중요한 용매로 작용 가능
2) 물의 용매 성질 ⋅친수성(Hydrophilic) 용질
- 극성으로 인해 이온화합물, 극성화합물을 쉽게 용해시킴
- 이온 화합물 : Na+, K+, Cl
- 이온 - 쌍극자 상호작용(이온수화 → 이온간 인력 감소)
- 극성화합물 : 알코올, 아민, 카르복실산 등 (N, O 보유)
- 쌍극자 - 쌍극자 상호작용(수소결합)
| ※ 전기음성도 : 전자를 끌어당기는 힘 ※ 극성:전자의 분포가 비대칭적으로 분산되어 있는 현상 ※ 친수성:그리스어로 hydro-는 물을 지칭하고, philic은 좋아하는 성질을 뜻하여, 물에 잘 녹는 성질을 말함 ※ 소수성 : 그리스어로 hydro-는 물을 지칭하며, phobic은 좋아하지 않는, 두려워하는 것을 의미 |

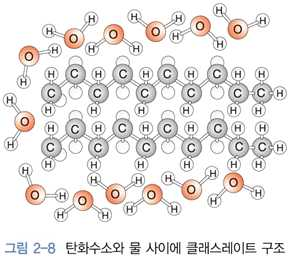
⋅소수성(Hydrophobic) 용질
- 전기음성도가 비슷한 탄소 - 수소로 구성된 물질들 → 비극성
예) 핵산(C6H12), 벤젠(C6H6)
- 물과 수소결합이 어려움 → 물에 용해되지 않음
- 이온화합물, 극성화합물 용해시키지 못함
- 클래스레이트 구조
⋅양쪽성(Amphiphilic) 용질
- 극성그룹과 비극성 그룹을 모두 갖는 물질 예) 지방산 금속염(RCOOK, RCOONa)
- 탄화수소 R기 : 소수성
- 카르복실산 COO-, Na+, K+ : 친수성
⋅미셸 : 물과 양쪽성 물질의 혼합시 형성되는 구조 예) 스테아르산 나트륨
- 극성머리 : 소디움카르복실산(COO-Na+) → 친수성 → 외부(물)
- 비극성꼬리 : 탄화수소(C17H35) → 소수성 → 내부
3. 물의 이온화 ⋅H2O → H+ + OH-
⋅양성자(H+)와 수산화(OH-) 이온으로 해리
⋅H+ 이온은 물과 반응하여 H3O+ 형성 → 편의상 H+ 사용
⋅질량작용법칙
- 생성물 농도들의 곱을 반응물의 농도 곱으로 나눈 값이 일정함

- 농도 :용액 1L 당 그 분자 몇 몰이 있는 지를 뜻함
- 물의 농도 구하기 : 1,000g/L ÷ 18g/mol = 55.5M
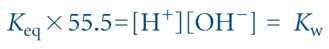
- Kw: 물의 이온적
- 25°C 물의 평형상수 Keq는 1.8 × 10-16 M

⋅물 한 분자 → H+, OH- 한 분자씩 해리
- [H+] = [OH-] = 1.0 × 10-7 M
- 즉, 25°C 물의 수소이온 농도는 1.0 × 10-7 M 임
4. pH ⋅물의 수소이온 농도 활용의 어려움 : 1.0 × 10-7M → pH 도입
⋅pH =-log [H+] = -log 1.0 × 10-7 = 7.0
⋅보통 수소이온 농도 : 100 ~ 10-14M → pH는 0~14까지 가능
⋅pH 5의 용액은 pH 6의 용액보다 수소이온 10배를 가짐
⋅[H+][OH-] = 1.0 × 10-14 이므로 모든 수용액에서 pH와 pOH의 합은 14임
5. 산과 염기
1) 산과 염기의 정의 ⋅산 : 수소이온을 내 줄 수 있는물질
HCl à H+ + ClCH3COOH à H+ + CH3COONH4+ à NH3 + H+
⋅염기 : 수소이온을 받아들이는 물질
Cl- + H+ à HCl
CH3COO- + H++ à CH3COOH
NH3 + H+ à NH4+
⋅HA(산) → H+ + A
- HA 는 수소이온을 내주므로 산
- A- 는 역반응에서 수소이온을 받아들이므로 염기
- 서로 짝산-짝염기의 관계로 정의
HA와 A
2) 산의 해리상수 ⋅산의 강도 : 수소이온을 내줄 수 있는 정도(해리상수 Ka)
- Ka 가 클수록 H+로 많이 해리됨 à 강산 (HCl: 거의 100%)
- 약산 (CH3COOH : Ka=1.76 × 10-5M )

3) pKa ⋅pKa = -log Ka
- 일반적으로 2~14
⋅다양성자산 : 두 개 이상의 수소이온을 내어줄 수 있는 산
- 탄산, 인산, 시트르산, 숙신산 등
- 단계적으로 수소이온 방출, pKa1, pKa2, pKa3 등
⋅인산(H3PO4)의 수소이온 방출과정

- 1번째 해리반응 : H3PO4산, H2PO4-짝염기, pKa = 2.14
- 2번째 해리반응 : H2PO4-산, HPO42-짝염기, pKa = 7.20
- 3번째 해리반응 : HPO42-산, PO43-짝염기, pKa = 12.4
6. 헨더슨-하셀발흐 방정식 ⋅pH와 pKa 사이의 관계 방정식
- 이로부터 우리는 다음을 알 수 있음
- 일정한 pH하에서 용액의 약산과 그 짝염기의 비율
- 약산과 그 짝염기 농도에 따른 용액의 pH

7. 적정곡선과 pKa 값 ⋅적정 : 농도를 아는 용액을 사용하여 미지 용액의 농도를 결정하는 방법
⋅적정곡선의 변곡점 → 산의 pKa 값
⋅아세트산 100ml를 수산화나트륨으로 적정

⋅수산화나트륨 50ml 첨가시
- CH3COO- : CH3COOH = 5:5
8. 완충용액
1) 완충용액의 정의 ⋅산이나 알칼리를 첨가해도 pH의 변화가 작음 : 완충작용
- 완충작용을 할 수 있는 용액 : 완충용액
⋅사람의 정상 혈액의 pH : 7.4 ± 0.05
⋅pH < 7.35 : 산독증
⋅pH > 7.45 : 알칼리혈증
⋅생체는 완충용액 시스템을 가지고 있음 → 보통 약산과 그 짝염기로 구성
2) 완충용액의 능력 ⋅완충용액능력을 결정짓는 요소
- 약산과 그 짝염기의 몰 농도의 합(농도) → 합이 클수록 큼
- 약산과 그 짝염기의 비율 → 1:1일 때 완충능력이 가장 큼
⋅효과적인 완충 범위
- 각 산의 pKa ±1 범위
- 아세트산과 아세트산염으로 이루어진 완충용액의 경우
- pKa가 4.76이므로 3.76~5.76 범위가 효과적임
3) 혈액 및 세포내액의 완충용액 ⋅세포내액의 완충용액

- 인산이 주요 완충제 역할을 함
- 인산의 pKa2 = 7.20, H2PO4, HPO42-쌍이 약산과 짝염기
⋅혈액의 완충용액
- 탄산이 주요 완충제 역할을 함
- H2CO3/HCO3 쌍이 약산과 짝염기(탄산/중탄산염)
⋅탄산의 pKa1 = 6.37 → 완충용액 범위에 겨우 들어감
⋅HCO3-와 H2CO3의 비율은 약 20:1 → 효율성이 떨어짐
⋅따라서, 폐에서 CO2를 매개로 완충능력을 나타냄
⋅체내 산 증가시 HCO3-가 작용→ 폐에서 CO2내보냄 → pH 증가
⋅체내 염기 증가시 HCO3-가 작용 → CO2가 혈액에 녹아 들어감 → pH 감소
<정리 문제>
문제1. 약산과 그 짝염기의 농도 비율이 같은 경우 산의 해리상수가 용액의 pH와 같다는 것을 나타내는
공식은 다음 중 무엇인가? [2017년_3번]
① 미카엘리스 - 멘텐 방정식
② 라인웨버 - 버크 방정식
③ 핸더슨 - 하셀발흐 방정식
정답 ③ ④ 위 ①②③ 중 답이 없음
문제2. 핸더슨-하셀발흐 방정식에 의하면 다음 중 어떤 조건하에서 pH와 pKa가 같아지는가?
[2018년_2번]
① 약산의 농도가 그 짝염기의 농도보다 높을 때
② 약산의 농도가 그 짝염기의 농도보다 낮을 때
③ 약산의 농도와 그 짝임기의 농도가 같을 때
정답 ③ ④ 위 CD, (2), CID 중 답이 없음
문제3. pH가 7인 용액과 pH가 5인 용액을 가장 잘 비교한 것은? [2018년_32번]
① pH 5인 용액이 2배 더 염기성이다.
② pH 5인 용액이 100배 더 산성이다.
③ pH 5인 용액이 100배 더 염기성이다.
정답 ② ④ pH 5인 용액이 2배 더 산성이다
문제4. 어떤 수용액의 [OH-]가 1×10-10M이다. pH로 나타내었을 때 그 값으로 옳은 것은?
[2016년_16번]
정답 ④ ① 10 ② 8 ③ 6 ④ 4
문제5. 어떤 수용액의 pH가 10이었다. 이때 pOH의 값으로 옳은 것은? [2017년_16번]
정답 ④ ① 10 ② 8 ③ 6 ④ 4
문제6. 어떤 수용액의 pOH가 9일 때 pH의 값으로 옳은 것은? [2018년_11번]
정답 ④ ① 3 ② 9 ③ 7 ④ 5
문제6. 다음 중 완충용액의 능력에 영향을 주는 요인으로 가장 옳은 것은 무엇인가? [2016년_17번]
① 주변의 온도
② 약산과 그 짝염기의 몰 농도의 합
③ 약산과 그 짝염기의 비율
정답 ④ ④ 위 ②, ③ 모두
문제7. 다음 중 완충용액의 능력에 대한 설명으로 옳은 것은? [2017년_20번]
① 약산과 그 짝염기의 몰 농도의 합이 작을수록 크다.
② 약산과 그 짝임기의 비율이 1:1일 때 완충능력이 가장 크다.
③ 약산과 그 짝염기의 몰 농도의 합과는 관련이 없다.
정답 ② ④ 약산과 그 짝염기의 비율과는 관련이 없다.
문제8. 약산과 그 짝염기의 몰 농도의 합이 클수록 완충용액의 능력은 어떻게 되는가? [2018년_27번]
① 완충용액의 능력이 커진다.
② 완충용액의 능력이 작아진다.
③ 완충용액의 능력은 변화가 없다.
정답 ① ④ 정답 없음
문제9. 소금이 물에 잘 녹는 이유로 가장 적절한 것은 무엇인가?
① 물분자가 소금의 양이온과 음이온에 수소결합을 하기 때문이다.
② 물분자가 소금의 양이온과 비극성 공유결합을 하기 때문이다.
③ 물분자가 소금 이온의 주위를 둘러싸 이온간 인력이 감소하기 때문이다.
정답 ③ ④ 물분자가 극성 공유결합을 하기 위해 소금이온과 전자를 공유하기 때문이다.
문제10. 어떤 용액의 pH가 7이라면 수소이온의 농도는 어떻게 표현되는가?
정답 ④ ① 7 ② 7 × 10-7 ③ 7 × 10-1 ④ 1 × 10-7
문제11. 수소결합과 친수성 상호작용에 대한 설명으로 옳은 것은?
① 분자 내 원자들 간의 약한 화학 결합
② 분자 내 원자들 간의 강한 화학 결합
③ 서로 다른 분자들 간의 약한 화학 결합
정답 ③ ④ 서로 다른 분자들 간의 강한 화학 결합
문제12. 약산의 해리상수에 대한 설명으로 옳은 것은?
① 값은 보통 1보다 작다
② 일반적으로 2보다 크다
③ 생체 내에서 거의 발견되지 않는다
정답 ② ④ 완충용액과 관련이 없다
문제13. 산과 염기의 가장 큰 차이를 잘 설명한 것은?
① 염기는 극성분자인데 반해 산은 그렇지 않다
② 산은 극성분자인데 반해 염기는 그렇지 않다
③ 염기는 수소이온을 공여하고 산은 수소이온을 받는다
정답 ④ ④ 산은 수소이온을 공여하고 염기는 수소이온을 받는다
※ 부족하지만 글의 내용이 도움이 조금이라도 되셨다면, 단 1초만 부탁드려도 될까요? 로그인이 필요없는 하트♥(공감) 눌러서 블로그 운영에 힘을 부탁드립니다. 그럼 오늘도 행복한 하루 되십시오^^
'생화학' 카테고리의 다른 글
| 식품, 영양 관련 쉽게 정리한 생화학 핵심 요점 요약 정리 6. 탄수화물 (0) | 2022.05.05 |
|---|---|
| 식품, 영양 관련 쉽게 정리한 생화학 핵심 요점 요약 정리 5. 효소 (0) | 2022.05.04 |
| 식품, 영양 관련 쉽게 정리한 생화학 핵심 요점 요약 정리 4. 아미노산, 펩티드 및 단백질 (1) | 2022.05.03 |
| 식품, 영양 관련 쉽게 정리한 생화학 핵심 요점 요약 정리 3. 생체에너지학 (2) | 2022.05.02 |
| 식품, 영양 관련 쉽게 정리한 생화학 핵심 요점 요약 정리 1. 세포 (0) | 2022.04.30 |