5. 효소
들어가기
⋅효소는 생물계에 존재하는 반응 촉매임
⋅활성화 에너지 낮춤 → 화학반응 촉진
⋅대부분의 효소는 단백질(일부 RNA, 리보자임 제외)
⋅기질특이성, 효소-기질 복합체를 형성함
⋅보조인자 필요(무기이온 또는 조효소 등)
⋅복잡한 구조 때문에 다른 물질에 의해 조절됨
1. 효소의 개요
1) 효소의 성질
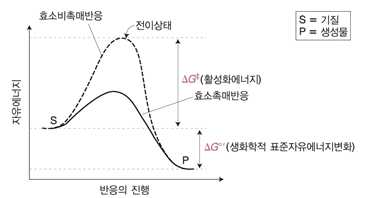
⋅화학반응 속도를 증가시키는 촉매제, 소모되지 않음
⋅화학반응에 필요한 활성화에너지를 낮추는 역할을 함
→ 즉, 활성화에너지 감소 → 반응속도 증가 → 표준 자유에너지변화는 없음
⋅촉매활성은 단백질 구조에 의존 → 변성/분해시 촉매활성 소멸함
⋅높은 특이성을 가짐, 한 개 또는 소수의 기질과만 반응함
⋅기질은 효소단백질 표면 활성부위와 결합, 반응에 필수적임
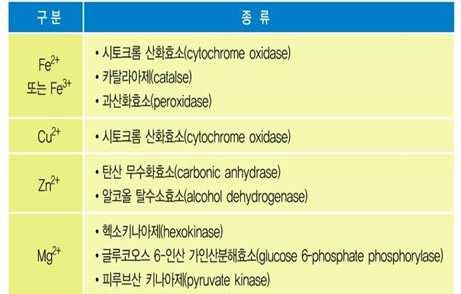
⋅기질 이외에 양이온, 조효소 등의 보조인자를 필요로 하기도 함
→ Fe2+ , Mg2+ , Mn2+ , Zn2+ 등
(금속이온, 산화-환원반응 촉매)
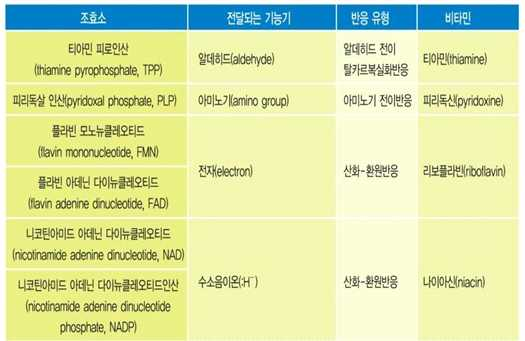
→ TPP, PLP, FMN, FAD, NAD, NADP, CoA 등
(비타민 유래 조효소, 특정 기능기 운반체로 작용함)


| ※ 용어 설명 ⋅자유에너지 : 화학적 일을 하는 데 이용할 수 있는 에너지 ⋅자유에너지 변화 : 반응계의 자유에너지 변화, 반응에서 생성물과 반응물 간의 총체적인 자유에너지 변화 ⋅표준 자유에너지 변화 : 표준조건(298K, 1기압, 1M)에서 반응의 자유에너지 변화 ⋅생화학적 표준 자유에너지 변화 : pH 7.0에서 표준자유에너지 변화 ⋅활성화에너지 : 반응을 시작하기 위해 필요한 에너지 투입량, 기질을 높은 에너지의 중간 물질로 전이하는 데 필요한 에너지 ⋅전이상태 : 생성물을 생성하는데 필요한 양의 에너지와 원자 배열을 갖춘 상태 ⋅기저상태 : 안정되고 에너지가 낮은 형태(정반응 또는 역반응의 시작점) |
⋅조효소
- 단백질이 아닌 물질로, 효소반응의 일부를 담당하고 반응이 끝난 다음 재생되는 물질, 유기
화합물 또는 금속 유기화합물, 비타민 등이 조효소의 전구체가 됨
- 조효소(coenzyme) → 단백질이 아닌 물질, 효소반응의 일부 담당, 반응 후 재생
⋅보결분자단(prosthetic group)
- 효소와 공유결합으로 단단하게 결합되어 있는 조효소, 금속이온
⋅완전효소(holoenzyme) → 보조인자들이 결합하여 완전한 촉매작용을 가지고 있는 효소
⋅아포효소(apoenzyme) → 완전효소의 단백질 부분
2) 효소의 반응속도에 영향을 주는 인자
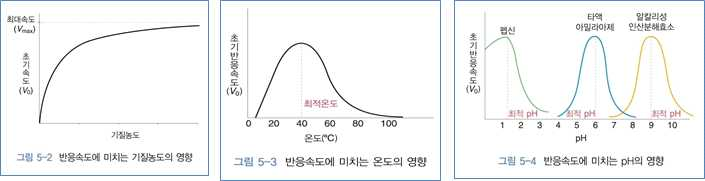
① 기질의 농도 : 비례한다.
② 온도 : 비례 하지만 최적온도 이상이 되면 변성될 수 있음
③ pH : 효소의 최적 pH는 효소마다 다름
3) 효소의 분류
⋅국제생화학분자생물학회(IUBMB)에서 명명법을 제시함
⋅접미사 ‘-ase(아제)’
- 산화환원효소 : 전자의 전이, 산화환원반응을 촉매
- 전이효소 : 기능기의 전달반응 촉매
- 가수분해효소 : 가수분해반응 촉매
- 분해효소 : 이중결합으로 기능기 첨가 또는 역반응 촉매
- 이성질화효소 : 분자 내 기능기 전이 → 분자내 재배열 촉매
- 연결효소 : 두 기질의 화학결합 촉매 → ATP 분해와 짝지어진 축합반응
2. 효소의 작용기전 (1)효소 촉매 반응
- 기질(효소의 활성부위와 결합해서 효소작용을 받는 분자, substrate) → 효소의 활성부위에
결합 → 복합체 형성 → 전이상태 → 생성물
(2)효소 - 기질의 결합과정 설명 모델
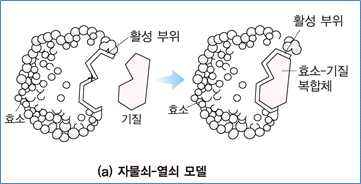
① 자물쇠-열쇠모델(lock-and-key model)
- 자물쇠와 열쇠같이 특이적인 반응이 서로 상보적인 형태로 분자 표면에서 상호작용을 한다는 이론
- 단백질 입체 구조의 유연성을 고려하지 않음
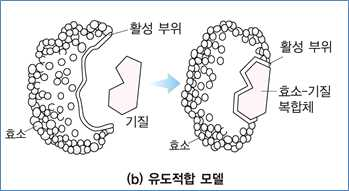
② 유도적합 모델(induced fit model)
- 효소와 기질이 결합
→ 효소 자체의 입체 구조적 변화
→ 기질과 여러 상호작용이 새롭게 형성된다는 이론
- 유도적합에 의해 효소의 특정 기능기는 최적의 위치로 이동
→ 효소 입체 구조의 변화에 의해 많은 약한 결합이 형성된다는 이론
| ※ 산, 염기 : 브뢴스테르-로우리의 정의에 따르면 산은 양성자 공여체이고 염기는 양성자 수용체임 ※ 친핵체 : 결합에 이용할 수 있는 전자쌍을 가지고 있어서 화학반응에서 핵과 같은 양전하 중심을 찾는 원자나 분자(Cl -, OH-) ※ 친전자체 : 화학반응에서 결합에 이용할 수 있는 전자나 분자를 찾는 원자나 분자(Cl 2, H3O+) |
1) 근접과변형 효과
⋅효소+기질 결합으로 유도되는 구조적 재배치 → 많은 약한 결합을 형성 → 전이상태를 안정화
⋅결국, 에너지 차이를 낮추어 반응을 효율적으로 촉매함
2) 일반산 또는 일반염기 촉매
(H +나 OH-가 아닌 다른 산이나 염기가 관여할 때의 촉매작용)
⋅일반 산 촉매작용 → 효소 활성부위에서 기질에 양성자를 제공하는 아미노산
⋅일반 염기 촉매작용 → 효소 활성부위에서 기질로부터 양성자를 받는 아미노산
3) 정전기적 촉매(electrostatic catalysis)
⋅효소 활성부위는 칙핵제(nucleophile) 또는 친전자체(electrophile)로 작용 할 수 있는 기능기
를 가지고 있어 기질과 이온결합이 가능함
⋅염기성, 산성 아미노산 또는 금속 보조인자로부터 형성 가능
4) 공유결합성 촉매(covalent catalysis) ⋅효소 활성부위의 잔기가 기질과 일시적으로 공유결합 형성 → 기질-효소 복합체를 형성 → 생성물
⋅아미노산 곁사슬기가 효소의 친핵체로 작용 → 시스테인(-SH), 아스파르트산, 글루탐산, 히스티딘 등
3. 효소의 반응속도론
⋅일정시간 동안에 일어나는 반응물이나 생성물의 농도 변화 → 반응속도
⋅A + B → P(A,B는 반응물, P는 생성물)
⋅반응속도 V : 반응물의 소멸속도 또는 생성물의 생성속도
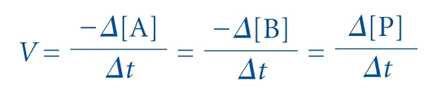
⋅어느 주어진 한 순간의 반응속도는 반응물이 생성물을 만드는 빈도에 비례함
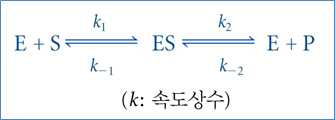
1) 미카엘리스-멘텐 반응속도론 ⋅효소(E)는 기질(S)과 결합하여 비교적 빠른 가역반응에 의해 효소-기질복합체(ES)를 생성한 후,
ES는 서서 히 분해되어 생성물(P)과 유리상태의 효소(E)를 생성함
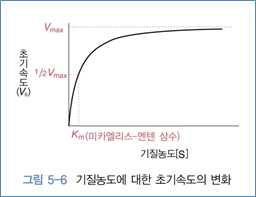
⋅곡선의 아래쪽은 1차 방정식, 속도(V)가 기질농도([S])에 비례하여 증가
⋅곡선의 위쪽은 0차 방정식, 포화로 인해 반응속도의 증가가 어려움
⋅기질의 농도가 충분히 높을 때의 반응속도가 최대 속도(Vmax)
⋅미카엘리스-멘텐식

⋅초기속도가 최대속도(Vmax)의 절반이 되는 경우 Km 값

⋅미카엘리스-멘텐 상수는 초기속도(V0)가 최대속도(Vmax)의 절반이 될 때 기질의 농도임
⋅기질이 효소에 얼마나 쉽게 결합하는지를 나타내는 척도
⋅Km이 클수록 기질이 효소에 대한 친화도는 낮아짐
⋅Km은 효소의 기질에 대한 친화도의 지표로 사용되며, 효소와 기질에 따라 다름
⋅미카엘리스-멘텐의 반응은 2단계로 이루어짐
⋅전환수 (turnover number, Kcat)
- 효소가 기질로 완전히 포화 시 효소 1몰, 1초당 생성물로 전환되는 기질의 몰 수
- V0은 E0와 S의 농도에 의존하는 2차 반응속도식
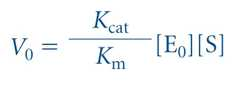
- Kcat/Km이 증가하면 촉매작용이 효율적임, 그 값은 상한이 있음
- 그 상한은 수용액 중에 효소와 기질이 서로 확산되는 속도에 의해 결정됨
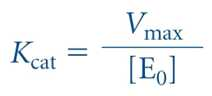
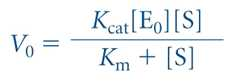
2) 라인위버-버크 이중역수도시법
⋅미카엘리스-멘텐식의 양변에 역수를 취하고 직선식으로 변형시킨 것
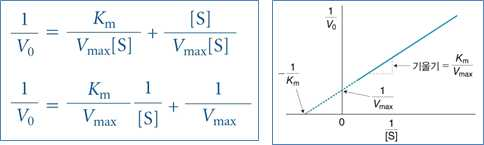
⋅최대반응속도(Vmax)나 미카엘리스-멘텐 상수(Km)를 보다 정확히 계산이 가능함
⋅효소활성에 대한 저해제의 기전 분석이 가능함
4. 효소활성의 저해
⋅효소저해제(enzyme inhibitor, I)는 효소의 작용을 방해하고 촉매반응속도를 감소시키는 물질임
⋅가역적인 형태와 비가역적인 형태가 있음
① 가역적 저해제
- 효소와 비공유결합을 형성한 후, 가역적으로 저해제들이 제거되어 효소를 원래 상태로 회복시킴
- 기질-효소 결합부위에 따라 경쟁적, 비경쟁적, 불경쟁적 저해제로 분류
▸경쟁적 저해제 : 효소의 활성부위에 기질 유사체(저해제)가 결합함으로써 효소 활성이 감소되는 작용
- 저해제가 효소 활성 부위에 결합 → 효소-저해제 복합체(EI)를 형성
- 기질이 충분할때 → 저해제 결합가능성 최소 → Vmax 불변, Km 증가
예) 말론산 → 숙신산 탈수소효소의 경쟁적 저해제
▸비경쟁적 저해제 : 저해제가 효소의 활성 부위가 아닌 다른 부위에 결합하여 효소 활성이 저해되는 작용
- 활성부위가 아닌 곳에 결합 → 기질-효소 결합에 방해 없음
- 하지만, 효소와 효소–기질복합체 모두에 결합 → 효소 불활성화
- Km 불변, Vmax 감소
▸불경쟁적 저해제 : 저해제가 효소-기질 복합체에만 결합하여 효소 활성이 저해되는 작용
- 효소-기질 복합체(ES)에만 결합
- Km, Vmax 모두 감소
- 라인위버-버크 도시법에서 두 직선은 평행함
② 비가역적 저해제
⋅효소와 결합하여 효소활성이 없는 단백질을 생성하여 제거되지 않으므로 원래의 상태로 회복시킬 수 없음
⋅효소 활성 부위와 공유결합 또는 매우 안정한 비공유결합을 형성함
⋅촉매활성에 필요한 기능기를 영구적으로 불활성화 시킴
5. 효소활성의 조절작용
⋅조절효소(regulatory enzymes)
→ 가장 느린 반응(속도조절단계)을 촉매함으로써 전체의 반응 속도를 조절하는 효소가 됨
⋅대부분 첫 번째 단계 효소가 조절효소인 경우가 많음
- 다른자리입체성 조절
- 공유결합 변형에 의한 조절
- 불활성형 전구체의 가수분해에 의한 활성 조절
- 효소 합성의 유도와 억제
1) 다른자리입체성 조절
⋅다른자리입체성 효소 : 조절인자와 결합하기 위한 조절부위(다른자리입체성 부위)를 1개 이상 가지고 있음
⋅조절인자가 기질과 같은 경우 : 동종효소(homotropic enzyme)
⋅조절인자가 기질과 다른 경우 : 이종효소(heterotropic enzyme)
▸되먹임저해(feedback inhibition)
- 연속반응의 최종산물이 반응경로의 첫 번째 반응을 저해하는 것으로 최종 산물 저해작용이라고도 함
(예) 아스파르트산 카르바모일 전이효소의 되먹임 저해
▸아스파르트산 카르바모일 전이효소의 되먹임 저해
⋅최종산물이 과다하게 존재할 때는 일련의 반응들 전체가 시작부터 정지되어 중간산물의 축적을
막을 수 있기 때문에 되먹임 저해는 효율적인 조절기전임
⋅S자형 포화곡선 → 효소의 협동적 작용 양상을 나타냄
⋅음성 조절인자(CTP) : 곡선 우측이동, S자 형태가 더 심해짐
⋅양성 조절인자(ATP) : 곡선 좌측이동, 쌍곡선 형태에 가까워짐
| ※ 속도조절단계 : 가장 많은 활성화에너지를 필요로하여 전체 반응속도를 조절하는 단계 |
2) 공유결합 변형에 의한 조절 ⋅세린, 트레오닌, 티로신 등(수산기 함유)
→ 인산기가 첨가 또는 제거됨
→ 공유결합 변형 → 효소 구조에 변화
→ 기능이 변함
⋅인산화 반응을 촉매하는 단백질 키나아제(protein kinase) 는 대사의 조절작용에서 중요한 역할을 함.
(예) 글리코겐 가인산분해효소의 활성은 인산화와 탈인산화에 따라 조절됨
3) 불활성 전구체의 가수분해에 의한 활성의 조절
⋅지모겐(zymogen) : 펩티드결합의 특이적인 가수분해에 의해 활성화될 수 있는 효소의 불활성형 전구체
⋅공유결합(펩티드결합)의 절단에 의한 가수분해에 의해 활성화
⋅(예) 위나 췌장에 있는 단백질 분해효소들
4) 효소 합성의 유도와 억제
⋅유전적 통제에 의해 효소의 합성 속도를 증가(유도) 또는 감소(억제) 시킴으로써 효소 활성을 조절
⋅(예) 고혈당으로 인슐린 수치 증가 시 포도당 대사 관여 효소들 합성 증가
⋅단, 이러한 형태의 조절은 속도가 느림
→ 기능 발현 위해 고차 구조 형성, 분해, 보조인자 결합 등을 거쳐야 함
<확인문제>
문제 1. 다음 중 효소반응에 대하여 라인위버-버크 도시를 이용하여 그래프를 그릴 때, X축과 Y축이 나
타내는 것으로 옳게 짝지어진 것은? (단, [S]와 υ는 각각 기질의 농도와 효소반응속도를 나타낸다.)[2016년 7번]
X축 Y축 X축 Y축
① [S] υ ② [S] 1/υ
③ 1/[S] 1/υ ④ 1/[S] υ
정답 ③
문제 2. 비경쟁적 저해제는 효소의 활성 부위와는 다른 부위에 결합하므로 기질과 효소의 결합을 방해하
지는 않는다. 이 경우미카엘리스 상수(Km)와 최대속도(Vmax)는 어떤 영향을 받는가? [2016년 10번]
① Km은 증가, Vmax는 감소
② Km은 감소, Vmax는 증가
③ Km은 불변, Vmax는 감소
정답 ③ ④ Km은 불변, Vmax는 증가
문제 3. 다음 중 조효소와 비타민 연결이 바르지 않은 것은? [2016년 19번]
① FAD – 피리독신(pyridoxine)
② NAD - 나이아신(niacin)
③ TPP – 티아민(thiamine)
정답 ① ④ 조효소 A - 판토텐산(panthothenic acid)
문제 4. 효소반응에 대하여 라인위버-버크 도시를 이용하여 그래프를 그릴 때, X축은 1/[S], Y축은 1/υ
를 각각 뜻하게 된다. [S]와 υ는 각각 무엇을 의미하는가? [2017년 7번]
① [S] : 효소반응속도, υ : 미카엘리스-멘덴 상수
② [S] : 효소반응속도, υ : 기질의 농도
③ [S] : 기질의 농도, υ : 효소반응속도
정답 ③ ④ [S] : 미카엘리스-멘텐 상수, υ : 기질의 농도
문제 5. 경쟁적 저해제는 효소의 활성 부위에 결합하여 효소-저해제 복합체를 형성하는데, 이 경우 미카
엘리스 상수(Km)와 최대속도(Vmax)는 어떤 영향을 받는가? [2017년 10번]
① Km은 증가, Vmax는 감소
② Km은 감소, Vmax는 불변
③ Km은 증가, Vmax는 불변
정답 ③ ④ Km은 감소, Vmax는 증가
문제 6. 라인위버-버크식에서는 X축의 절편은 -1/Km, Y축의 절편은 1/Vmax로 표시된다 다음 중 직선의
기울기를 올바르게 표시한 것은? (단, Km은 미카엘리스-멘텐상수, Vmax는 최대반응속도) [2018년 5번]
① Km ÷ Vmax
② Vmax ÷ Km
③ Km × Vmax
정답 ① ④ Km + Vmax
문제 7. 불경쟁적 저해제는 기질이 결합하는 효소의 활성 부위와는 다른 부위에 결합하는데, 이
경우 미카엘리스 상수{Km)와 최대반응속도 V/max)는 어떤 영향을 받는가? [2018년 7번]
① Km은 감소, Vmax는 감소
② Km은 증가, Vmax는 증가
③ Km은 증가, Vmax는 감소
정답 ① ④ Km은 감소, Vmax는 증가
문제 8. 다음 중 조효소와 이를 구성하는 비타민의 연결이 올바르지 않은 것은? [2018년 33번]
① TPP - 티아민(thiamine)
② FAD - 피리독신(pyridoxine)
③ 조효소 A - 판토텐산(panthothenic acid)
정답 ② ④ NAD+ - 나이아신(niacin)
문제 9. 다음 중 효소활성에 대해 바르게 설명한 것으로 묶인 것은?
㉮ 온도, pH, 기질농도, 압력 등의 영향을 받는다.
㉯ 조절효소의 반응속도는 기질과 효과인자의 농도에 의존한다.
㉰ 티로신 잔기는 효소활성 조절을 위한 효소 단백질의 인산화를 유발한다.
㉱ 효소의 구조적 변화와 효소의 활성부위도 효소활성에 영향을 미친다.
정답 ③ ① ㉮㉯㉰㉱ ② ㉮㉰ ③ ㉯㉱ ④ ㉮㉯㉰
문제 10. 지모겐(zymogen)은 효소의 불활성화된 전구체를 말한다. 다음 중 지모겐에 포함하지 않는 것은?
정답 ④ ① 트립시노겐 ② 펩시노겐 ③ 키모트립시노겐 ④ 포스포릴라아제
문제 11. 숙신산이 푸마르산으로 될 때, 호르몬인 숙신산 탈수소효소가 관여한다. 이 때, 이 효소를 저해하
는 경쟁적 저해물은 무엇인가?
정답 ④ ① 젖산 ② 구연산 ③ α-케토글루타르산 ④ 말론산
문제 12. 2H2O2 → 2H2O + O2에 관여하는 효소는 카탈라아제(catalase)이다. 이 때, 이 효소가 함유하는
금속이온으로 옳은 것은?
정답 ② ① Zn2+ ② Fe2+ ③ Mg2+ ④ Mn2+
문제 13. 다음 중 조효소와 비타민 연결이 옳지 않은 것은?
① TPP –티아민(thiamine)
② FAD –피리독신(pyridoxine)
③ 조효소 A –펜토텐산(panthothenic acid)
정답 ② ④ NAD -나이아신(niacin)
※ 부족하지만 글의 내용이 도움이 조금이라도 되셨다면, 단 1초만 부탁드려도 될까요? 로그인이 필요없는 하트♥(공감) 눌러서 블로그 운영에 힘을 부탁드립니다. 그럼 오늘도 행복한 하루 되십시오^^
'생화학' 카테고리의 다른 글
| 식품, 영양 관련 쉽게 정리한 생화학 핵심 요점 요약 정리 7. 탄수화물 대사 (0) | 2022.05.06 |
|---|---|
| 식품, 영양 관련 쉽게 정리한 생화학 핵심 요점 요약 정리 6. 탄수화물 (0) | 2022.05.05 |
| 식품, 영양 관련 쉽게 정리한 생화학 핵심 요점 요약 정리 4. 아미노산, 펩티드 및 단백질 (1) | 2022.05.03 |
| 식품, 영양 관련 쉽게 정리한 생화학 핵심 요점 요약 정리 3. 생체에너지학 (2) | 2022.05.02 |
| 식품, 영양 관련 쉽게 정리한 생화학 핵심 요점 요약 정리 2. 물 (0) | 2022.05.01 |