3. 생체에너지학
1. 열역학법칙 ⋅우주(universe)는 계(system)와 주위(surrounding)로 구분된다.
- 고립된 계 : 주위와 물질이나 에너지가 교환되지 않는 계
- 닫힌 계 : 주위와 에너지를 교환하나 물질은 교환되지 않는 계
- 열린 계 : 주위와 에너지, 물질 모두를 교환할 수 있는 계
1) 열역학제 1법칙 ⋅에너지 보존의 법칙
⋅물리적 ⋅화학적 변화에도 우주의 총 에너지는 항상 일정함
2) 열역학제 2법칙 ⋅모든 자발적인 반응에서 엔트로피(무질서의 정도)가 증가하는 방향으로 일어남.
(ΔS는 양(+)으로 표시)
⋅영양소 대사 시 CO2, H2O, 열 방출 → 주위 엔트로피 증가
- 우주의 엔트로피는 증가
2. 자유에너지
1) 자유에너지의 정의 ⋅반응으로부터 일을 할 수 있는 가용에너지의 척도 (G)
⋅깁스(Gibbs)의 자유에너지 (H는 엔탈피 : 열 함량의 척도)
⋅단위는 joule/mol, cal/mol (1 joule/mol = 0.239 kcal/mol)
⋅일정한 온도와 압력 하에서 자유에너지 변화
2) 자유에너지 변화와 반응의 자발성

⋅ΔG < 0 이면, 자유에너지 감소 반응으로 반응은 자발적
⋅ΔG = 0 이면, 자유에너지의 변화가 없는 반응으로 평형상태
⋅ΔG > 0 이면, 자유에너지 증가반응으로 자발적으로 일어나지 않으며 반응이 일어나려면 에너지가 요구
3. 화학반응에서 자유에너지 변화 ⋅자유에너지 변화(ΔG)는 반응의 자발성 정도와 반응으로부터 얻을 수 있는 유용한 에너지 양을
의미함 → 근육 수축, 세포 이동, 이온/분자의 막 이동 및 조직의 성장에 필요함.
⋅ΔG는 온도, 압력, 반응물과 생성물의 농도 및 pH에 따라 달라짐
⋅여러 반응들의 자유에너지 변화 비교를 위해 표준상태의 자유에너지를 측정하여 일정한 근거자
료로 사용
⋅표준 상태 : 1기압, 25oC, 반응물, 생성물 각 1몰, pH 0
⋅표준자유에너지 변화 : ΔGo, pH 7인 경우 ΔGo'
| ※ 엔트로피(S) : 어떤 계 또는 주변에서 무질서와 무작위의 측정치로서, 조직화되고 질서가 잡힌 상태는 엔트로피가 낮고, 무질서 한 정도가 높은 상태는 엔트로피가 높음 |
4. 고에너지 화합물 ⋅생물체의 에너지 이용 : 고에너지화합물이나 조효소에 중개, 산화 또는 가수분해하여 이용
⋅고에너지화합물 : 반응 후 자유에너지 감소가 매우 큰 물질
- 반응물 : 정전기적 반발로 인한 결합의 변형 → G 높음
- 생성물 : 이온화, 공명화, 엔트로피의 증가 효과 → G 낮음
⋅가수분해에 따른 정전기적 반발 상쇄 → 안정화
⋅생성물의 이온화 → 공명화 구조 증가 → 안정화
⋅가수분해반응 → 용액 중 분자 수 증가 → 엔트로피 증가
1) 피로인산 화합물

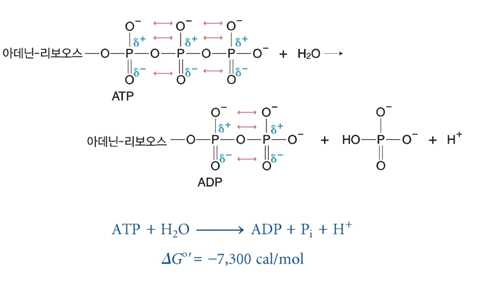
⋅두 개의 인산기에서 물이 빠지면서 연결된 피로인산 → 가수분해 → 많은 G 방출
- ATP(아데노신 삼인산) 등
⋅생합성 이용의 예
- UTP : 다당류 합성
- GTP : 단백질 합성
- CTP :지질 합성
- ATP, GTP, CTP, UTP, dATP, dGTP, dTTP : 핵산 합성
⋅ATP(-4가), ADP(-3가) → 생체 내 Mg2+ 와 연결
- ATP(-2가). ADP(-1가)의 복합체 형성
⋅반응물인 피로인산(ATP)의 정전기적 반발
- 인 : 양전하끼리의 반발, 산소 : 음전하끼리의 반발 → 높은 에너지 포함
- 생성된 이온에는 반발 감소 → 많은 에너지 방출
⋅ADP도 ATP와 동일
⋅AMP는 더 적은 에너지 방출
- 분자 내 반발 없으므로
⋅ATP가 AMP와 피로인산으로 가수분해 시
- 생성물에 정전기적 반발 존재 → -7,300 cal/mol의 두 배 아닌 -8,600 cal/mol
2) 아실인산화합물

⋅가수분해 시 자유에너지를 많이 생성함
- 해당과정의 DPG
- 반응물의 정전기적 반발
- 생성물의 이온화 통한 공명구조

3) 엔올인산화합물 ⋅포스포엔올피루브산(PEP)

- 반응물 PEP가 엔올형태(불안정) → 높은 자유에너지
- 생성물 피루브산 → 호변이성 →케토 형태의 이성질체
4) 구아니듐인산화합물
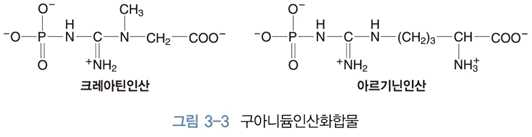
⋅크레아틴인산, 아르기닌인산 등
- 생성물(구아니듐)이 반응물(구아니듐인산)보다 더 많은 공명구조
- 구아니듐인산 : 인 옆의 질소가 공명구조 어려움
- 구아니듐 : 인산기가 없으므로 질소의 공명구조 가능
| ※ 엔올(enol) : 'en'은 이중결합이 존재함을 의미하며, 'ol'은 OH기를 갖고 있다는 뜻임. ※ 호변이성 : 불안정한 엔올형이 안정적인 케토형의 이성질체로 변하는 현상으로서 이때 많은 자유에너지가 나옴 ※ 근육의 에너지 저장형태 : 크레아틴인산, ATP ※ thio 는 황을 의미함 ※ 이중 결합과 단일 결합이 교대로 있을 때 각 결합의 결합 차수가 변하는 현상을 공명이라고 부르며, 그 공명을 통해서 나타나는 구조를 공명 구조라고 한다 |
5) 티오에스테르

⋅아세틸 CoA, 숙시닐 CoA 등
⋅반응물 : 황(S)으로 인해 공명 구조 어려움
⋅생성물의 카르복실기(COO-)는 공명구조 가능 → 안정화
5. 반응의 짝지움 ⋅모든 대사 반응은 ΔG<0 이어야 자발적
⋅반응물과 생성물의 농도에 따라 반응이 달라짐
- 0보다 큰 경우 존재함 → 짝지움을 통해 자발적 반응
⋅자유에너지 증가반응과 자유에너지 감소반응을 짝지움 (예)생체 내에서 일어나는 짝지움 반응
- A → B에서 ΔGo' = +10kcal/mol(endergonic)
- C → D에서 ΔGo' = -30kcal/mol(exergonic)
- A+C → B+D 짝지움 ΔGo' = -20kcal/mol
⋅PEP의 예(-7.5kcal/mol)
- 자유에너지 감소반응 : PEP → 피루브산(-14.8kcal/mol)
- 자유에너지 증가반응 : ADP → ATP (+7.3kcal/mol)
6. ATP의 중요성 ⋅생물체는 영양소를 산화시켜 생성된 에너지를 저장했다가 사용
→ 고분자 물질의 합성, 물질의 능동 수송, 근육 수축 등
⋅ATP는 생물체 내에서 자유에너지를 중개하는 에너지 화폐(free energy currency)로 사용
1) ATP가 에너지 화폐의 역할을
할 수 있는 구조적 이유 ⋅인산기 전이전위가 중간정도 → 중간운반체 역할
⋅ATP의 가수분해는 자발적 반응 (ΔGo'<0)이지만 촉매(ATPase)필요
2) 에너지 충족률 ⋅생물체는 에너지 충족률(energy charge)에 따라 꼭 필요할 때만 ATP를 생성
⋅하나의 ADP는 1/2 ATP에 해당
7. 산화환원반응과
자유에너지 변화(ΔGo)
1) 산화환원반응의 정의 ⋅생체 내 산화환원반응은 전자의 이동에 의한 반응이 대부분
⋅산화환원반응에서는 한쪽은 전자를 잃고, 또 다른 한쪽은 전자를 받아들이는 전자의 이동이
일어나므로 산화제와 환원제 모두 있어야 함
- 산화제(electron acceptor) : 환원되는 물질(전자를 받아들이는 물질)
- 환원제(electron donor) : 산화되는 물질(전자를 잃는 물질)
| ※ 표준환위 : 전자를 받아들이는, 즉, 환원하는 능력으로 V(voltage)로 표시함 |
2) 산화환원반응과
자유에너지 변화의 관계 ⋅한 물질의 산화제나 환원제로서의 역할을 항상 정해져 있는 것이 아니라 환경에 따라 달라짐
(예) 철과 구리의 반응
⋅자발적 반응 : 자유에너지 차이 ΔGo와 연관지어 생각
⋅환원전위(E) : 1기압, 25°C인 표준상태에서 수소이온이 환원되는 표준환원단위를 0V로 정함
⋅이 때 표준상태에서 수소이온농도는 1M, 즉 pH = 0을 의미함
⋅pH 7일 때의 표준환원전위(E o) : -0.420V
⋅반쪽 반응이 짝지워진 경우에는
- 환원전위 값이큰 것 → 환원반응
- 환원전위 값이 작은 것 → 역반응인 산`화반응
<개념 문제>
문제 1. 만약 어떤 반응의 엔탈피(H)변화가 0이라면, 표준자유에너지 변화(ΔG°)를 나타내는 기호식은
무엇인가? [2016년 12번]
정답 ④ ① InKeq ② TΔS∘ ③ -ΔH∘ ④ -TΔS∘
문제 2. 고에너지 화합물이 분해될 때 발생하는 표준 자유 에너지변화의 설명으로 가장 옳은 것은?
[2016년 30번]
① 공명구조에 의해 생성물이 안정화된다.
② 활성화 에너지가 증가한다.
③ 수소결합에 의해 생성물이 불안정화된다.
정답 ① ④ 반응물의 자유에너지가 낮다.
문제 3. 만약 A → B의 반응에서 표준자유에너지 변화가 -80KJ/mol 이라면, 표준상태에서 일어날 수
있는 반응으로 옳은 것은? [2017년 4번]
① 자발적 반응방향을 예측할 수 없다.
② 정반응이 자발적으로 일어난다.
③ 역반응이 자발적으로 일어난다.
정답 ② ④ 반응이 일어나지 않는다.
문제 4. 만약 A → B의 반응에서 표준자유에너지 변화가 -180KJ/mol 이라면, 표준상태에서 일어날 수
있는 반응으로 옳은 것은? [2018년 3번]
① 반응이 일어나지 않는다.
② 역반응이 자발적으로 일어난다.
③ 정반응이 자발적으로 일어난다.
정답 ③ ④ 자발적 반응방향을 예측할 수 없다.
문제 5. 다음 중 근육조직에서 에너지 저장형태로 알맞은 것은?
정답 ④ ① cAMP ② ADP ③ PEP ④ creatin phosphate
문제 6. A → B 반응의 표준자유에너지 변화가 –40KJ/mol 이라면, 반응은 어떻게 진행되는가?
① 평형상태로 반응이 일어나지 않는다.
② 절대 평형상태가 될 수 없다.
③ 빠른 속도로 반응이 일어난다.
정답 ④ ④ 왼쪽에서 오른쪽으로 자발적인 반응이 일어난다.
문제 7. A → B 반응의 표준자유에너지 변화는 -60kj/mol 이라고 한다. 초기에 10mmol의 A가 존재하
였고 B는 없었던 경우, 24시간 후에 측정하였더니 B가 2mmol, A가 8mmol이 생성되어 있었다.
이를 올바르게 설명한 것은?
① A와 B는 평형상태의 농도에 도달하였다.
② B의 생성 속도는 느려서 평형에 도달하지 못하였다.
③ B의 생성은 열역학적으로 불리하다.
정답 ② ④ 표준자유에너지 변화만으로 이 현상을 설명하기는 불가능하다.
문제 8. 화학반응에서 자유에너지 변화(ΔG)가 의미하는 것은 무엇인가?
㉮ 반응의 자발성 정도
㉯ 자발적인 반응이 아니다.
㉰ 반응으로부터 얻을 수 있는 유용한 에너지의 양
㉱ 자유에너지 변화는 엔트로피와 관련이 없다.
정답 ② ① ㉮㉯㉰㉱ ② ㉮㉰ ③ ㉯㉱ ④ ㉮㉯㉰
문제 9. 자유에너지를 변화시키는 조건으로 옳지 않은 것은?
정답 ③ ① 온도 ② 압력 ③ H2O ④ pH
'생화학' 카테고리의 다른 글
| 식품, 영양 관련 쉽게 정리한 생화학 핵심 요점 요약 정리 6. 탄수화물 (0) | 2022.05.05 |
|---|---|
| 식품, 영양 관련 쉽게 정리한 생화학 핵심 요점 요약 정리 5. 효소 (0) | 2022.05.04 |
| 식품, 영양 관련 쉽게 정리한 생화학 핵심 요점 요약 정리 4. 아미노산, 펩티드 및 단백질 (1) | 2022.05.03 |
| 식품, 영양 관련 쉽게 정리한 생화학 핵심 요점 요약 정리 2. 물 (0) | 2022.05.01 |
| 식품, 영양 관련 쉽게 정리한 생화학 핵심 요점 요약 정리 1. 세포 (0) | 2022.04.30 |