제8장 효소반응

|
⦁proprotein : 특별한 기능을 가지는 단백질이 활성이 없는 상태로 합성된 전구체
⦁결합자리 : 효소의 활성자리의 기질이 결합하는 부위
⦁경쟁적 저해(competitive inhibition) : 효소 활성자리에 기질과 함께 경쟁하여 효소의 활성을 감소하는 저해
⦁다른자리효소(allosteric enzyme) : 4차구조의 효소에서 한 단위체에 효과인자가 결합하여 다른 단위체의 활성이 변화하여 조절되는 효소
⦁되먹임조절(feed back control) : 여러 단계로 이루어진 반응에서 후반부 단계의 생산물이 앞쪽 단계의 효소에 영향을 주어 반응속도가 조절되는 현상
⦁리보자임(ribozyme) : ribonucleotide로 구성되어 있으면서 기질을 변화시키는 양태가 효소와 동일한 것. 효소와 동일한 양태로 기질을 변화시킨다 함은 기질의 농도가 변화할 때 반응속도가 미하엘리스-멘텐식에 따라 변화함을 의미한다.
⦁미하엘리스-멘텐상수(Michaelis-Menten constant:Km) : 최대반응속도의 절반의 반응속도에 필요한 기질의 농도를 의미한다. 이는 효소와 기질의 결합성향(친화도)을 나타내는 것으로서 효소마다 특정한 값을 가진다.
⦁미하엘리스-멘텐식(Michaelis-Menten equation) : 기질의 농도와 효소의 반응속도 관계를 합리적으로 정리한 식
⦁불경쟁적 저해(uncompetitive inhibition) : 효소-기질복합체에만 결합하여 활성을 감소하는 저해제
⦁비경쟁적 저해(noncompetitiv inhibition) : 저해제가 기질이 효소에 결합하는 것을 방해하지는 않으나 저해제가 효소 혹은 효소-기질복합체와 결합함으로써 효소의 활성이 낮아지는 현상이다. 이 경우 저해제가 효소에 결합하는 자리와 기질이 효소에 결합하는 자리가 동일하지 않다.
⦁아이소엔자임(isoenzyme) : 아이소자임과 동일한 의미를 가지는 동의어
⦁아이소자임(isozyme) : 동일한 종(種)의 생물체에서 동일한 기능을 가지지만 구조가 다른 효소. 아이소자임은 다른 생물체 혹은 동일 생물체 내에 존재할 수 있다.
⦁알로자임(allozyme) : 동일한 유전자의 대립유전자에 유전정보가 존재하면서 동일한 기능을 가지는 효소
⦁압자임(apzyme) : 특정 항원에 대한 항체가 효소와 동일한 체계로 반응하여 소향으로 항원을 빠른 속도로 변화시키는 촉매
⦁율속단계(rate determining step, rate limiting step) : 여러 단계로 이루어진 반응에서 전체 반응속도에 가장 크게 영향을 미치는 반응으로서 전체 반응속도를 좌우하는 단계. 이 단계의 반응속도가 빠르면 전체 반응속도도 빠르고 이 단계의 반응이 느리면 천체 반응속도도 느리게 된다. 일반적으로 반응속도가 가장 느린 단계이다.
⦁자이모겐(zymogen) : 활성이 없는 상태로 합성된 효소
⦁전이상태(transition state) : 기질-효소복합체가 반응이 진행되기 위해서 형성되는 고에너지 준위의 상태
⦁전환수(kcat) : 기질이 포화된 상태에서 효소 1개(혹은 1mole)가 단위시간(1총)당 기질을 생산물로 전화한 개수 (혹은 mole 수)
⦁조효소(coenzyme) : 효소의 반응을 도와주는 유기물 보조인자
⦁촉매자리 : 효소 활성자리의 기질이 생산물로 전화되는 부위
⦁프로엔자임(proenzyme) : 자이모겐과 동일한 의미를 가지는 동의어
⦁활성자리(active site) : 효소구조에서 반응을 진행시키는 부위
⦁활성화착물(activated complex) : 반응물끼리 결합하여 반응이 진행될 수 있는 형태
⦁효소 특이성(specificity) : 특정한 반응만을 촉진하는 효소의 특성
⦁효소(enzyme) : 유기촉매로서 활성화 에너지를 낮추어 반응속도를 증가시킨다.
|
8.1. 효소의 구성

1) 단순단백질 효소
⦁효소는 유전정보가 발현되어 합성되는 단백질이다.(단백질
로만 구성된 효소)
2) 복합단백질 효소
⦁단백질 외의 유기물과 금속원소가 결합하여 형성된 복합단
백질 효소는 구성성분에 대한 특별한 명칭이 있다.
㉮ 복합단백질 효소 전체를 완전효소(holoenzyme)라 한다.
㉯ 단백질 부위를 불완전효소(apoenzyme)라 하고, 비단백
질성 부위를 보조인자(cofactor)라 한다. 보조인자가 유기물
인 경우 이를 조효소(coenzyme)라 한다.
㉰ 비단백질성 부위가 단백질과 강하게 결합되어 있어 효소의 일부로 인정되는 경우 이를 보결분자단(prosthetic group)이라 한다.
8.2. 효소의 구조
⦁효소반응은 반응대상물인 기질(원료,substrate)의 결합, 기질의 생산물(product)로의 전환, 생산물의 효소로부터의 분리 순서로 진행된다.
㉮ 반응이 일어나는 장소를 활성자리라 하고, 활성자리 외의 부위는 활성자리가 바른 구조를 유지할 수 있도록 지원한다.
㉯ 활성자리는 기질이 결합하는 결합자리, 기질이 생산물로 전환하는 촉매자리로 구성되어 있다.
㉰ (자물쇠와 열쇠 모델, lock and keymodel) 기질이 활성자리에 결합하는 것은 원래 결합자리가 기질이 잘 결합할 수 있는 형태를 갖
추고 있거나, (유발적합 모델, induced-fit model)기질이 근접하면서 촉매자리가 기질이 결합할 수 있는 모양으로 변화하기 때문이다.
⦁활성자리에서 기질과 효소의 결합, 반응 등의 상호관계는 비공유결합에 따른다. 활성자리의 극성과 전하는 pH의 영향을 받기 때문
에 효소의 활성은 pH에 따른다. 기질이 결합하여 위치가 안정해지면 아미노산 3~5개의 작용기에 의해 생산물로 전환된다.
8.3. 효소의 종류와 명칭
⦁효소의 명칭은 관용명, 계통명, EC 번호 세 종류가 있다. 효소 분류의 첫단계는 6종류(①산화환원요소 ②전달효소 ③가수분해효소 ④분해효소 ⑤이성질화 효소 ⑥연결효소)로 분류한다.
㉮ 관용명은 과학적인 효소 명명체계가 확립되기 전에 효소 발견자가 마음대로 붙인 명칭이다(예: lactase).
㉯ 계통명은 반응 종류, 기질의 내용을 포함하는 명칭이다(예: -D-galactoside galactohydrolase).
㉰ EC명은 반응의 종류를 4단계로 구체적으로 분류하여 붙인 명칭이다(예: EC 3.2.1.23).

8.4. 효소반응

1) 효소반응 단계
⦁ 효소가 존재하지 않은 상태에서는 반응대상물인 기질이 전이상태(transition state: X+)를 거쳐
생산물로 전환다. 전이상태란 기질이 생산물로 전환되기 직전의 에너지 함량이 높은 상태이다.
⦁ 효소에 의한 반응은 기질(S)이 효소(E)와 결합하여 효소-기질복합체(ES)를 형성하고, 전이상태
(EX+)에 이른 후 생산물(P)로 전환된다. E+S ⇄ ES ⇄ EX‡ ⇄ E+P
㉮ 효소에 의한 반응은 기질(S)이 효소(E)와 결합하여 효소-기질복합체(ES)를 형성하고, 전이상태(EX‡)에 이른 후 생산물(P)로 전환하
면서 효소(E)가 유리된다. 효소가 없는 상태에서 일어나는 반응에 비하여 효소-기질복합체가 형성되는 과정이 더 있다.
㉯ 효소는 정반응뿐만 아니라 그 역반응도 촉진한다. 그러므로 기질농도가 대단히 높고, 생산물의 농도가 매우 낮은 반응 초기를 제외하고는 ‘E+S ⇄ ES ⇄EX‡ ⇄ E+P’의 정반응과 역반응이 함께 일어난다. 반응 초기의 반응은 ‘E+S ⇄ ES ⇄ EX‡→ P’으로 표현한다.
8.4.2 효소 반응 특성
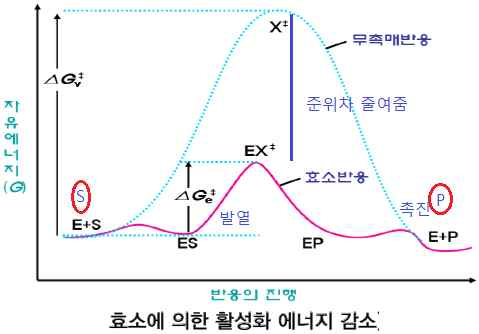
⑴ 특이성 : 특이성은 생물체의 필요에 따라 개별효소의 합성을 조절하여 특정한 반응을 촉진 혹은 제어함으로써 필요한 반응만이 진행되도록 할 수 있는 근거가 된다
㉮ 특정 반응만을 촉매하는 반응특이성이 있다.
㉯ 특정 기질에 의한 반응만을 촉진하는 기질특이성이 있다.
⑵ 지속성 : 효소는 합성된 후에 세포에 장기간 존재하면서 지속적으로 사용될 수 있다. 이는 생물체가 몸체를 효율적으로 운영할 수 있는 요인 중 하나이다.
- 효소는 반응을 완료한 후 구조가 변화하지 않고 생산물로부터 분리되기 때문에 효소가 변성되지 않는 한 계속해서 반응을 촉진 할 수 있다.
⑶ 반응속도 증가
- 효소에 의한 반응속도의 증가는 반응이 평형상태에 도달하는 시간을 단축하는 것이지 평형상수를 변화시키는 것이 아니다. 효소가 반응의 본질를 변화시키지 않기 때문에 대상반응이 정상수준에서 지속될 수 있다.
- 효소가 반응속도를 증가시키는 것은 활성화 에너지가 감소하기 때문이다. 생물체 대사반응속도는 대단히 빨라야 하는데 생물체 체온처럼 낮은 온도에서 효소가 존재하지 않은 상태에서는 반응속도가 상당히 느리기 때문에 생물체가 생명을 유지할 수 없다. (대사반응에서 효소는 높지 않은 온도에서 반응이 신속하게 진행)
- 효소는 전이상태의 자유에너지 준위를 낮춘다. 즉, 활성화 에너지를 감소시킨다. 그러므로 전이상태에 도달할 수 있는 자유에너지를 가지는 기질의 양이 증가함으로써 반응속도가 증가한다. 기질이 효소와 결합하여 효소-기질복합체(ES)를 형성한 후에 전이상태로 바뀌는데 이때 결합에너지가 방출된다. 이때에 기질과 효소의 결합이 최대에 이르면서 안정해진다. 방출된 결합에너지가 활성화 에너지의 일부를 보상하기 때문에 효소-전이상태 기질복합체의 자유에너지가 낮더라도 반응이 진행될 수 있다.
- 효소는 활성화 에너지를 감소하여 반응속도를 촉진한다. 효소가 기질과 결합할 때 결합에너지가 방출되는데 방출된 에너지만큼이 효소가 존재하지 않을 때의 활성화 에너지의 일부를 보상하기 때문에 반응에 필요한 활성화 에너지가 감소하여 반응속도가 증가한다.
⑷ 평형상수 불변
반응속도를 증가시켜 반응평형에 도달하는 시간을 단축할 뿐이지 평형상수,즉 반응이 진행되는 정도에는 변화가 없다.
8.4.3 활성의 표현
- 효소의 활성이란 단위량의 효소가 단위시간 동안에 반응을 진행시키는 정도이다. 효소의 양은 mg 혹은 mole, 시간은 분 혹은 초가 사용되며, 반응을 진행시킨 정도는 생산물로 전환된 기질의 mole 혹은 μmole이 사용된다.
㉮ IU(international unit, μmole/min): 1분에 생산물로 전환한 기질의 μmole 수
㉯ katal: mole/sec, 1초에 생산물로 전환된 기질의 mole 수
㉰ 비활성(specific activity): 효소 1mg의 IU 활성
㉱ 전환수(turnover number): 기질이 충분한 상태에서 효소 1mole이 1초 동안에 생산물로 전환한 기질의 mole 수. 혹은 효소 1개가 1초 동안에 생산물로 전환한 기질의 개수. 전환수가 효소의 정확한 활성이다.
8.5. 반응속도에 영향을 미치는 요인
8.5.1 기질의 농도

- 효소반응에서는 기질농도가 낮을 때에는 기질농도가 증가하면서 반응속도가 비례하여 증가하지만, 기질의 농도가 상당한 수준으로 증가하면 반응속도가 증가하는 정도가 감소하며, 기질의 농도가 매우 크면 반응속도가 일정하게 유지되는 시기에 다다른다. 이는 효소반응의 특징적인 현상이며, 이러한 현상을 식으로 정리한 것이 미하엘리스-멘텐
(Michaelis-Menten)식이다.(환경조건에 관계없이 효소마다 특정기질에 대하여 일정하다) 미하엘리스-멘텐식으로부터 다음과 같은 사실을 도출할 수 있다.
㉮ 반응속도가 더 이상 증가하지 않는 상태의 반응속도를 이 반응의 최대반응속도(Vmax)라 한다. 최대반응속도는 반응조건(효소의 양, 온도, pH 등)에 따라 다를 수 있다.
㉯ Km 최대반응속도의 1/2(절반)의 반응속도에 필요한 기질의 농도를 Km(미하엘리스-멘텐상수)라 한다. 이 값은 효소마다 반응조건에 관계없이 일정하며, 기질과의 친화성(결합을 잘 하는가 여부)을 나타내는 지표로서 효소반응의 효율성과 직접적인 관계가 있다. 즉 값이 적을수록 친화성이 높은 효소이다
㉰ Kcat(전환수)는 효소의 특정한 조건에서의 활성을 나타내는 고유한 값이다. 즉 Kcat이 클수록 활성이 큰 것이다. Kcat과 Km모두 효소
의 활성을 나타내는 지표인데 이 두 값을 한데 묶어 표기하면 효소의 활성을 더 효율적으로 나타낼 수 있다. Km은 적을수록, Kcat이 클수록 효소의 활성이 좋은 것이기 때문에 Kcat/Km으로 묶으면 효소의 활성을 매우 효과적으로 나타낼 수 있으며 효소의 활성을 판단하는 지표로 널리 사용된다. Km은 효소와 기질의 친화성을 나타내는 지표이긴 하지만 기질이 생산물로 전환하는 속도를 표현하지는 않는다. 그러므로 Kcat과 함께 묶어 표현함으로써 효소의 활성을 효과적으로 표현할 수 있다. 효소의 활성은 Kcat에 비례하고 Km에는 반비례하기 때문에 Kcat/Km값이 큰 효손는 반응을 촉매하는 능력이 좋은 것이며, 이는 세포에서 개별 효소의 활성을 판단하는데 매우 유용하다.
8.5.2 온도
- 효소반응에서도 온도가 낮으면 반응속도가 낮고, 온도가 높으면 반응속도가 증가한다. 그러나 온도가 너무 높으면 효소가 불활성화 하여 반응속도가 낮아진다. 온도가 낮을 때 반응속도가 낮은 것은 기질과 접촉하는 데 필요로 하는 운동에너지가 충분히 공급되지 않고, 전이상태에 도달할 수 있는 에너지가 부족하기 때문이다.
- 온도가 높아지면 효소분자의 3차구조에 기여하는 화학결합 중에서 약한 결합이 분해되면서 효소구조가 변화하여 활성을 잃게 된다
8.5.4 pH – 적절한 긍성, 하전상태
- 효소반응은 효소와 기질 모두의 이온화 상태와 관련한 현상이다. 그러므로 pH가 변화하면 효소와 기질의 이온상태가 변화하면서
반응속도가 달라진다. 반응이 최대에 이르는 적정 pH로부터 매우 먼 pH에서는 효소구조가 변화하기 때문에 반응속도가 매우 낮다.
8.6. 효소와 대사반응 조절
8.6.1 기질, 생산물, 반응보조인자의 농도
㉮ 기질, 생산물, 반응보조인자는 대사반응에서 독립적으로 작용하기도 하지만 상호 연관되어 대사반응을 조절하기도 한다. 대체적으
로 기질과 반응보조인자 농도가 증가하면 대사반응이 증가하고, 생산물 농도가 증가하면 대사반응이 감소하거나 중지된다.
㉯ 생산물은 흔히 되먹임조절(feed back control)에 의해 대사반응 속도를 조절한다. 되먹임조절이란 연속해서 여러 단계에 걸쳐 일
어나는 반응에서 최종 단계에 생성된 물질이 초기 단계 반응의 효소에 영향을 미쳐 반응속도가 조절되는 경우이다. 이 경우 효소활성
은 다른자리효소(allosteric enzyme)의 체계로 조절된다. 다른자리효소란 여러 개의 단위체로 구성된 효소에서 한 단위체에 특정 물
질이 결합하여 다른 단위체의 활성이 변화하는 효소이다.
㉰ 반응보조인자는 활성자리에 직접 결합하거나 다른자리효소 체계에 의해 대사반응을 조절한다.
8.6.2 아이소자임(isozyme) ▸동종효소 : 기질결합 부위의 서열은 다르지만 같은 대사에 관여
- 동일한 종류의 반응을 촉매하지만 구조가 다른 효소들이 동일한 종(species)에 존재할 때 이를 아이소자임(isozyme)이라 한다. 이
들은 반응과 관련한 특성이 다르며 각기 그들이 존재하는 부위의 환경에 적절한 특성을 가지고 있다.
- 아이소자임은 생체 내에서 반응조건과 기질의 농도가 다른 환경에서 동일한 반응이 진행될 수 있게 하거나, 반응물과 생산물에 대
한 특이성이 다름으로써 정반응과 역반응이 적절하게 일어날 수 있도록 한다. -각기 고유의 km을 가짐
8.6.3 전구체
- 효소가 활성이 없는 상태로 생산된 후에 필요한 장소로 이동하여 활성을 가지는 경우가 있는데, 이와같은 효소를 전구체(pro
enzyme)라 한다. 전구체는 생산된 후에 구조 중 일부가 가수분해되어 제거되면 활성이 있는상태로 전환된다. 이는 효소가 생산되는
장소되는 장소와 반응을 촉매하는 장소가 달라야 하는 경우에 유용한 체계로서, 단백질 소화효소 중에는 전구체로 생산되는 것이 많
이 있다. 소화효소는 반응을 촉진해야 할 장소에서 활성화함으로써 효소가 분비되는 부위의 단백질조직이 분해되지 않도록 한다.
- 효소가 생산되는 부위와 활동하는 부위가 동일하지 않은 경우 전구체(zymogen, proenzyme)로 생산된 후 활동해야 하는 부위에
이동하여 활성을 가지는 구조로 전환한다.
8.6.4 공유결합적 변환
- 효소구조의 작용기에 특정한 원자단이 공유결합으로 결합하거나, 결합되었던 것이 제거되면서 효소가 활성을 가지게 되는 경우가
있다.
8.6.5 저해제
저해제는 효소의 활성자리에 결합하여 기질이 결합하는 것을 방해하거나 활성자리의 구조를 간접적으로 변화하여 반응의 기능을 상
실케 한다. 저해제는 세포내에서 대사반응을 스스로 조절하는 조절제로서의 역할을 하거나, 질병치료제, 제초제, 살충제 등과 같이 외
부로부터 세포로 투입되어 세포가 사멸에 이르게 하는 독성으로 작용하기도 한다.
(1) 비가역적 저해제
비가역적 저해는 저해제가 효소와 공유결합으로 강하게 비가역적으로 결합하여 활성에 필요한 작용기를 불활성화한다.(페니실린)
(2) 가역적 저해제
가역적 저해제는 효소와 결합과 분리를 반복하면서 평형이 존재한다. (ex.제초제)
① 경쟁적 저해(competitive inhibition)
경쟁적 저해제는 기질과 경쟁하여 효소의 활성자리에 결합함으로써 저해하는 것인데 기질과 구조가 유사하다.
② 비경쟁적 저해(noncompetitive inhibition) - 비활성자리 부위 결합
비경쟁적 저해제는 효소가 기질과 결합하는 것을 저해하지 않으면서 효소 및 효소-기질복합체에 결합하여 효소를 불활성화한다.
저해제가 결합하는 부위는 활성자리가 아니다.
③ 불경쟁적 저해(uncompetitive inhibition)
불경쟁적 저해제는 효소-기질복합체에만 결합하여 효소를 불활성화한다.
<정리하기>
·효소는 단백질로 구성되어 있으며 효소에 따라 단백질 외의 성분을 함유하는 것도 있다. 단백질외의 물질 중 효소와 결합을 하면서 효소의 반응에 관여하는 유기물을 조효소라 한다.
·활성자리는 결합자리와 촉매자리로 구성되며 아미노산의 작용기가 중요한 기능을 담당한다. 기질이 결합자리에 결합하면 촉매자리가 반응을 진행 한다. 화성자이 외의 부분은 활성자리의 구조가 유지될 수 있도록 지원한다
·효소의 명칭은 관용명, 계통명, EC번호가 있으며, EC번호는 국제생화학분자생물학 연합회에서 효소의 반응 특성에 따른 분류에 근거하여 분류한다
·효소반응은 비효소반응과는 달리 효소-기질복합체가 존재하며, 기질의 전이상태는 효소에 결합된 상태에서 형성된다
·효소반응은 특이성, 신속성, 평형의 불변, 지속성 등의 특성이 있으며, 이 특성들은 모두 생물체 대사 및 생물체 운용에 유리한 점이다
·효소가 반응속도를 증가시키는 것은 기질이 활성자리의 작용기와 결합할 때 결합에너지가 방출되고, 방출된 에너지가 기질의 평균
자유에너지와 전이상태 에너지간의 차리을 보전함으로써 활성화 에너지를 낮추기 때문이다
·Km은 효소가 기질과 결합하는 친화성을 나타내는 지표이고, Kcat는 효소의 반응능력을 나타내는 지표이다. Km의 값은 친화성과 반비례하고, Kcat값은 반응능력에 비례하기 때문에 Kcat/Km값은 효소의 활성을 잘 판단할 수 있는 지표이다. Kcat/Km는 기질의 농도가 낮은 반응조건에서 도출된 개념인데, 세포의 기질농도가 낮아 세포에서 해당반응의 속도를 판단할 수 있는 정보를 제공한다
·온도가 낮을 때에 효소의 활성이 잔은 것은 기질의 평균 에너지가 낮아 활성화 에너지가 크기 때문이고, 온도가 높을 때 활성이 낮은 것은 효소의 변성이 원인이다
· 기질이 효소와 결합하고, 반응이 진행되기 위해서는 기질과 활성자리 작용기가 적절하게 극성을 띠고 이온화되어 있어야 하기 때문에 효소는 특정한 PH에서 활성이 좋다
·대상반응은 반응 관련 물질의 농도변화, 다른자리 효소의 되먹임조절, 아이소자임, 전구체, 공유결합적 변환등에 의해 효소반응을 촉진 혹은 제어함으로써 적절히 조절된다. 효소의 각종 저해제는 질병치료제, 제초제에서 널리 이용되는 조절방법이다.
·kcat/Km 은 효소 활성을 나타내는 중요한 지표이다.
·온도는 반응계에 에너지를 공급할 수 있는 정도를 나타내는 지표이다. 온도가 낮으면 운동에너지와 활성화 에너지 공급이 부족하고, 온도가 높으면 효소구조 유지에 기여하는 결합이 분해되어 활성이 낮거나 불활성화 한다.
·pH 는 기질과 효소의 극성 및 하전 상태를 결정하므로서 활성에 영향을 미친다.
·효소의 반응관련물질(기질, 생산물, 효과인자)의 농도 변화, 아이소자임, 전구체, 공유결합적 변환 등에 의해 대사반응이 조절된다
[정리]
⦁활성자리는 효소의 극히 일부이며, 기질이 결합하고 반응이 진행될 수 있는 공간과 아미노산 곁사슬 작용기가 존재한다.
⦁기질이 효소의 활성자리에 결합할 때 결합에너지가 방출되는데, 방출된 에너지가 반응에 필요한 에너지를 공급하기 때문에 활성화
에너지는 그만큼 낮아지게 된다.
⦁Km은 효소가 기질과 결합하는 친화도를 상당한 정도로 나타내는 지표로서 그 값은 기질과의 친화력과 반비례한다. Kcat은 효소활
성 능력에 비례한다. 그러므로 Kcat/ Km의 값은 효소의 기질과 친화도와 활성을 동시에 나타낸다.
⦁적정온도보다 낮은 온도에서는 기질의 평균 에너지 함량이 낮아 활성화 에너지를 공급하지 못하기 때문에 활성이 낮고, 높은 온도에서는 효소가 변성되기 때문에 활성이 낮다. 적정온도는 활성화 에너지를 충분히 공급하면서 효소가 변성되지 않는 온도이다.
⦁리보자임은 ribonucleotide로 구성되어 효소와 구성성분이 다르지만 기질농도 변화에 따른 활성의 역학(kinetics)이 미하엘리스-멘텐 반응속도론을 따르고, 3차구조 유지가 활성에 중요하고, 반응에 의해 구조에 변화가 없는 등 제반 반응과 관련한 특성이 효소와
동일하기 때문이다.
⦁복합단백질로 구성된 효소의 비단백질성 물질 중 유기물이 조효소이다.
⦁효소가 기질과 결합할 때 방출되는 결합에너지가 활성화 에너지의 일부를 대체함으로써 반응에 필요한 활성화 에너지가 매우 낮아진다. 그러므로 체온 정도의 높지 않은 온도의 환경에서 공급되는 에너지로 반응이 잘 진행될 수 있다.
⦁Km은 최대 반응속도의 절반에 해당하는 속도에 필요한 기질의 농도인데 이는 특정 효소에서 반응조건에 관계없이 고유한 값이다.
Km이 낮으면 효소의 기질에 대한 친화도가 좋은 것을 의미한다.
⦁효소의 적정 pH란 활성자리가 반응에 적절하게 이온화하거나 극성을 가질 수 있는 pH이다.
⦁단백질 효소가 전구체로 생산되는 것은 작용해야 할 장소에서만 활성을 가짐으로써 효소가 분비된 후 목적지에 도달하는 도중의 체단백질이 무분별하게 분해되는 것을 방지하는 장점이 있다.
[정리2]
1. 효소는 단백질로 구성되어 있으며 효소에 따라 단백질 외의 성분을 함유하는 것도 있다. 단백질외의 물질 중 효소와 결합을 하면서 효소의 반응에 관여하는 유기물을 조효소라 한다.
2. 활성자리는 결합자리와 촉매자리로 구성되며 아미노산의 작용기가 중요한 기능을 담당한다. 기질이 결합자리에 결합하면 촉매자리가 반응을 진행 한다.
3. kcat/Km 은 효소 활성을 나타내는 중요한 지표이다.
4. 온도는 반응계에 에너지를 공급할 수 있는 정도를 나타내는 지표이다. 온도가 낮으면 운동에너지와 활성화에너지 공급이 부족하고, 온도가 높으면 효소구조 유지에 기여하는 결합이 분해되어 활성이 낮거나 불활성화 한다.
5. pH 는 기질과 효소의 극성 및 하전 상태를 결정함으로서 활성에 영향을 미친다.
6. 효소의 반응관련물질(기질, 생산물, 효과인자)의 농도 변화, 다른자리 효소의 되먹인 조절, 아이소자임, 전구체, 공유결합적 변환 등에 의해 대사반응이 조절된다.
○ 효소의 구성
·단순단백질
·복합단백질 : 단백질과 유기물, 금속원소가 결합
·단백질 부위 : 불완전효소
·비단백질 부위 : 보조인자
보조인자가 유기물인 경우→조효소(coenzyme, CoA)
○ 효소의 구조
·활성자리 : 반응이 일어나는 자리(결합자리+촉매자리), 자물쇠와 열쇠모델, 유발적합 모델
·결합자리 : 기질이 결합
·촉매자리 : 기질이 생산물로 전환
○효소이 종류와 명칭 : 관용명, 계통명, EC명
○효소반응 : 효소↔효소-기질복합체↔생산물
○효소반응 특성 :
①특이성(반응특이성, 기질특이성)
②지속성
③반응속도 증가 : 효소가 기질에 결합할 때 에너지 방출, 방출된 에너지만큼 효소가 없을 때의 활성화에너지 보상
④평형상수 불변 : 시간 단축될 뿐 진행정도는 불변
○활성표현
①IU : 1분에 생산물로 전환한 기질의 µmole수
②katal : 1초에 생산물로 전환된 기질의 mole수
③비활성 : 효소 1mg의 IU활성
④전환수(kcat) : 기질이 충분한 상태(포화)에서
·효소 1mole이 1초 동안 생산물로 전환한 기질의 mole수
·효소 1개가 1초 동안 생산물로 전환한 기질의 개수
∴전환수가 효소의 정확한 활성이다.
○ 반응속도에 미치는 영향 : 기질의 농도, 온도, pH
○·kcat미하엘리스-멘텔상수) :
①최대방응속도의 1/2의 반응속에 필요한 기질의 농도
②환경조건에 관계없이 효소마다 특정기질에 대하여 일정
○ kcat/km : kcat이 클 수 록 km이 적을 수 록 활성이 좋음
○ pH : 적정 pH상태에서 적절한 극성과 하전상태(이온상태)가 됨.
○ 대사반응 조절 : 기질·생산물·반응보조인자의 농도, 아이소자임, 전구체, 공유결합적 변환, 저해체
○ 되먹임조절(feed back control) : 최종단계 생산물이 초기 단계 반응의 효소에 영향을 미쳐 반응속도 조절. 이 경우 효소활성은 다른자리효소의 체계로 조절.
○아이소자임(=아이소엔자임) : 동일한 종류의 반응을 촉매하지만 구조가 다른 효소들이 동일한 종(species)에 존재할 때
○전구체 : 효소가 분비된 후 목적지에 도달하는 도중 체단백질의 무분별한 분해 방지
○저해체 : 비가역적, 가역적(경쟁적, 비경쟁적, 불경쟁적)
○비효소 유기촉매
아이소보자임 : 효소반응과 유사하기 때문
<인강 연습문제>
1. 효소의 활성자리가 반응을 촉진시킬 수 있는 구조적 근거는 무엇이며, 그 구조와 효소활성과의 구체적인 관계는 무엇인가?
☞ 활성자리 아미노산 작용기. 활성자리 아미노산의 작용기와 기질이 결합된 후에 다른 아미노산의 작용기에 의해 생산물로 전환된다.
2. 효소에 의해 활성화에너지가 감소하는 이유와 활성화 에너지의 감소가 반응에 영향을 미치는 바를 제시하시오.
☞ 활성화 에너지 감소 이유- 효소가 기질과 결합할 때 에너지가 방출되는데 이 에너지가 활성화에너지의 일부를 보상하여 낮은 활성화
에너지로도 반응이 일어날 수 있도록 한다.
[반응에 미치는 영향]
①활성화 에너지를 낮춤으로서 반응상수가 대폭 증가하여 반응속도가 증가한다.
②낮은 온도에서도 반응이 일어 날 수 있도록 한다. 에너지는 반응 장소의 온도에 의해 공급되는데 필요한 에너지량이 작으므로 낮은
온도에서도 반응이 진행될 수 있다.
3. 온도가 낮거나 높을 때 효소활성이 낮은 이유는 무엇인가?
☞ 온도가 낮을 때 활성이 낮은 이유- 반응이 일어나기 위해서는 효소와 기질이 활발하게 운동하면서 부딪쳐야하기 때문에 에너지, 즉 운동에너지가 필요하다. 활성화 에너지를 공급받기 위해서 에너지가 필요하다. 온도는 에너지를 공급할 수 있는 주위의 조건이기 때
문에 낮은 온도에서는 운동에너지와 활성화에너지를 충분히 공급하지 못한다.
높은 온도에서 활성이 낮은 이유-온도가 높으면 효소구조를 유지하는 화학결합이 분해되기때문에 효소의 3차구조가 변화하면서 활성이 낮아지거나 불활성화 한다. 온도가 낮으면 하고, 온도가 높으면 효소가 불활성화 하기 때문이다.
4. 리보자임이 유기촉매인 이유는 무엇인가?
☞ 기질 농도변화에 따라 활성이 변화하는 양태가 미카엘리스-멘텐 식에 따르기 때문이다.
해설 : 자연계에 존재하는 촉매는 유기촉매와 무기촉매로 분류되고 유기촉매에는 효소가 해당한다. 기질의 농도변화에 따른 활성의 변
화가 미카엘리스의 식에 따르는 것은 효소뿐인 것으로 인정되어 왔으나 효소가 아닌 리보자임도 동일한 현상을 보였기 때문에 리보
자임을 유기촉매로 분류하였다.
Q3.일반적인 화학반응과 달리 효소반응의 특성은 무엇인가?
☞특이성, 지속성, 반응속도 증가 및 평형 불변
Q4.효소가 활성이 없는 상태로 생산된 후 필요한 장소 및 특정 처리를 통해 비로소 효소의 기능을 가지게 되는 효소는 무엇인가?
☞전구체
※ 부족하지만 글의 내용이 도움이 조금이라도 되셨다면, 단 1초만 부탁드려도 될까요? 로그인이 필요없는 하트♥(공감) 눌러서 블로그 운영에 힘을 부탁드립니다. 그럼 오늘도 행복한 하루 되십시오^^
'농업생물화학' 카테고리의 다른 글
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 10. 탄수화물 대사 (5) | 2022.11.30 |
|---|---|
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 9. 호르몬 (18) | 2022.11.27 |
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 7. 세포 (7) | 2022.11.25 |
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 6. 생체물질 (3) | 2022.11.24 |
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 5. 유기화학 (4) | 2022.11.23 |