5. 유기화학
⦁유기화합물(organic compound) : 탄소 간 결합으로 구성된 구조를 골격으로 하는 탄소화합물. 이산화탄소,
일산화탄소, KCN은 유기화합물로 인정하지 않는다.
⦁지방족 탄화수소(aliphatic hydrocarbon) : 탄소가 길게 결합한 사슬 형태에 수소가 결합하여 구성된 화합물
⦁알칸(alkane) : 단일결합으로만 구성되어 있는 지방족 탄화수소
⦁알켄(alkene) : 이중결합을 가지고 있는 지방족 탄화수소
⦁알킨(alkyne) : 삼중결합을 가지고 있는 지방족 탄화수소
⦁방향족 탄화수소(aromatic hydrocarbon) : 벤젠을 기본 구조로 하는 탄화수소
⦁아렌(arene) : 방향족 탄화수소의 다른 명칭
⦁알코올(alcohol) : 알코올기(-OH)를 가지고 있는 유기화합물
⦁알데히드(aldehyde) : 알데히드기(-CHO)를 가지고 있는 유기화합물
⦁케톤(ketone) : 케톤기(-C=O)를 가지고 있는 유기화합물
⦁카르복시산(carboxylic acid) : 카르복시기(-COOH)를 가지고 있는 유기화합물로서 약산이며, 이를 유기산이라 한다.
⦁유기산(organic acid) : 카르복시기를 가지고 있는 유기화합물
⦁지방산(fatty acid) : 카르복시기를 가지고 있는 지방족 탄화수소
⦁에테르(ether) : 알킬기(아릴기) 2개가 산소에 의해 연결된 것
⦁에스테르(ester) : 유기산과 알코올이 축합되어 물분자가 이탈하면서 형성된 화합물
⦁아민(amine) : 암모니아의 수소가 알킬기 혹은 아릴기로 치환된 것
⦁아미드(amide) : 아민과 카르복시산의 탈수반응에 의해 생성되는 화합물
⦁입체 이성질체(stereoisomer) : 구성 원자 및 원자단의 종류와 숫자가 동일하나 원자 및 원자단의 입체적 배치가
다른 화합물 간의 관계
⦁기하학적 이성질체(geometrical isomer) : cis/trans 이성질체를 일컬음
⦁거울상 이성질체(enantiomer) : 대칭의 관계에 있는 입체 이성질체
⦁부제탄소(asymmetric carbon) : 4개의 화학결합을 가지는 탄소로서 결합된 원자 혹은 원자단의 종류가 모두 다른 탄소
⦁키랄 탄소(chiral carbon) : 부제탄소의 다른 명칭
⦁편광(plane polarized light) : 빛은 직진하는 방향과 직각의 모든 방향으로 진동한다. 그러나 빛을 프리즘을
통과시키면 한 방향으로만 진동하면서 직진하게 된다. 이와 같이 한 방향으로만 진동하는 빛을 편광이라 한다.
⦁광학적 이성질체(optical isomer) : 화학적, 물지적 성질은 동일하지만 편광면을 회전시키는 방향이 다른 입체
이성질체
⦁에피머(epimer) : 1개의 부제탄소에 결합되어 있는 원자 및 원자단의 배치가 다른 입체 이성질체
⦁아노머(anomer) : 쇄상구조가 고리구조로 전환할 때 새로이 형성되는 부제타소의 원자 및 원자단의 배치가 다른
입체 이성질체

5.1. 유기화합물의 특성

ㅇ 구성
- 탄소골격에 H, O, N, P, S 등 결합된 탄소화합물
ㅇ 특성
- 안정성 : 탄소 전기음성도(2.5) → 공유결합
- 다양성 : 탄소 최외각 전자(4개), 탄소골격의 다양, 화학결합의 다양
㉮ 탄소와 탄소 간의 결합이 공유결합일 뿐만 아니라 탄소의 전기음성도가 중간이기 때문에 다른 원소와의 결합도 공유결합이 대부분이므로 매우 안정하다.
㉯ 탄소의 원자가전자가 4개이기 때문에 탄소사슬 골격의 모양이 다양하고, 탄소 간의 공유결합이 단일결합과 다중결합이 가능하며, 다른 원소들과도 화학결합을 할 수 있어 유기화합물의 종류가 다양하다. 이는 생물체에서 필요로 하는 모든 물질을 합성할 수 있는 근거가 된다.
㉰ 탄소화합물에 특정 작용기가 결합할 수 있어 특별한 기능을 가지는 물질이 합성될 수 있다.
→유기화합물은 탄소와 수소로 구성된 탄화수소의 골격에 작용기라 불리는 히드록시기, 케톤기, 알데히드기, 카르복실기, 아미노기 등이 결합되는 것이 있어 독특한 화학적, 물리적 특성을 가진다
5.2. 유기화합물의 분류
1) 탄화수소
탄소와 수소로 구성된 유기화합물
(1) 지방족 탄화수소 : 탄소들이 사슬모양으로 연결되어 있는 것으로서 탄소 간 결합의 종류, 탄소사슬의 고리구성 등에 따라 분류된다.
① 알칸 : 단일결합으로 구성된 탄화수소 ② 알켄 : 이중결합이 존재하는 탄화수소 ③ 알킨 : 삼중결합이 존재하는 탄화수소
④ 고리형 : 고리구조를 형성하는 지방족 탄화수소로서 탄소 간 결합의 종류에 따라 시클로알칸, 시클로알켄, 시클로알킨으로 분류한다.
(2) 방향족 탄화수소 : 벤젠핵을 기본 구조로 하는 탄화수소이며, 좋은 냄새가 나는 것이 많기 때문에 방향족 탄화수소라고 명명하였다.
2) 탄화수소-작용기
탄화수소에 작용기가 결합한 유기화합물로서 단백질, 탄수화물, 지질, 비타민,핵산 등이 이에 해당한다. 이들은 모두 생체에서 고유의기능을 담당한다.
5.3. 탄화수소
1) 지방족 탄화수소

⑴ 알칸 alkane CnH2n+2
① 명칭- 탄소 접두어-ane
불포화결합을 가지지 않는 지방족 탄화수소를 알칸(alkane)이라 한다. 탄소 수에 따른 접두어에 어미 -ane을 붙여 명명한다. 가지사슬이 존재하는 경우, 제일 긴 사슬을 골격으로 하여 탄소 순서대로 번호를 붙이되 가지사슬의 탄소번호가 가능한 작도록 번호를 붙인다. 가지사슬 탄소의 번호, 가지사슬 탄화수소 명칭의 형용사형, 골격탄화수소의 명칭 순서로 명명한다.
② 특성 – 비극성, 분자량 클수록 빙점,비점 상승(유발쌍극자힘)
㉮ 작용기가 없고, 모든 전자가 안정한 시그마결합에 참여하고 있기 때문에 화학반응성이 매우 약하여 안정하다.
㉯ 석유, 휘발유, 경유, 디젤 등 연료들은 모두 각종 알칸의 혼합물이다.

⑵ 알켄(alkene), 알킨(alkyne)
① 명칭 alkene : CnH2n alkyne : CnH2n-2
이중결합이 있는 탄화수소는 알켄(alkene), 삼중결합이 있는 탄화수소는 알킨(alkyne)이라 한다. 탄화수소 숫자에 따른 접두어에 -ene, -yne의 어미를 각각 붙인다. 가지사슬이 있는 경우 다중결합을 포함해서 가장 긴 사슬을 주 골격으로 하고, 다중결합 탄소의 번호가 가능한 작도록 탄소에 번호를 붙인다. 가지사슬 위치,가시사슬 명칭 형용사형, 다중결합의 위치, 탄소골격 명칭의 순서로 명명한다.
② 특성 –알칸보다 반응성 큼(파이결합전자)
불포화탄화수소의 파이결합 전자는 두 원자의 핵 사이의 축으로부터 멀리 떨어져 있기 때문에 포화결합의 시그마결합 전자보다 자유로워 반응성이 크다. 그러므로 알켄, 알킨은 반응성이 알칸보다 크며, 첨가반응을 한다.

⑶ 시클로알칸(cycloalkane)
여러 개의 탄소 원자가 고리처럼 결합해 있고 각각의 탄소 원자에 수소가 결합한 탄화수소를 말한다. 화학식은 CnH2n이다. 탄소의 수에 따라 시클로프로판(3개), 시클로부탄(4개), 시클로펜탄(5개), 시클로헥산(6개)이라 부른다.알케인과 마찬가지로 첨가반응을 하지 않고 치환반응을 한다. 분자가 작은 사이클로프로페인과 사이클로뷰테인 경우 고리가 끊어지기 쉽기 때문에 불안정하다. 또한 이들은 사슬모양의 불포화탄화수소 중 알켄과 이성질체 관계를 갖는다.
2) 방향족 탄화수소

① 명칭 – 벤젠 치환 탄소 명칭
방향족 화합물은 벤젠을 기본 구조로 한다. 벤젠의 수소와 치환된 원자단의 탄소번호가 가능한 적게 번호를 붙이고 치환원자단이 존재하는 탄소의 번호, 원자단 명칭의 형용사형, 벤젠의 순서로 명명한다. 2개 이상의 원자단이 치환되어 있는 경우는 탄소의 번호 대신 첫 원자단 다음 탄소부터 ortho, meta, para의 순서로 탄소 명칭을 부여하여 명명한다.

② 특성 – 알켄보다 안정
㉮ 벤젠고리의 이중결합으로 표시된 부위에 파이결합 전자들이 고정되어 배치되어 있는 것이 아니고 인접한 결합에 걸쳐 동일하게 분포되어 있다. 이를 공명이라 한다.
㉯ 방향족 탄화수소의 이중결합의 파이결합 전자들은 공명상태에 있기 때문에 지방족 탄화수소의 이중결합의 파이결합 전자보다는 핵과 가까이 존재하므로 반응성이 약하여 방향족 화합물은 알켄보다 반응성이 적다. 치환 반응을 한다.

5.4. 유기화합물의 작용기
ㅇ 작용기(functional group)
- 유기화합물의 탄화수소 외 부분
- 작용기에 따라 화합물의 구조와 성질 변화
ㅇ 기능
- 유기화합물의 물리적·화학적 특성
- 극성 혹은 이온상태로 존재
ㅇ 작용기(functional group)-화합물을 계열별로 분류가 가능하도록 만들어 주는 구조적인 특징. 탄화수소부분은 반응성이 매우 낮은데 반해 작용기는 극성을 가지고 있거나 수용액에서 이온상태로 존재하기 때문에 반응성이 강하여 작용기가 해당 분자의 특성에 큰 영향을 미친다.

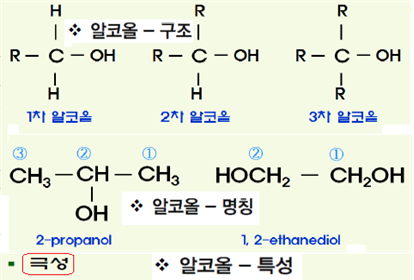
1) 알코올
① 명칭
알코올기를 히드록시기(hydroxyl group)라고도 한다. 탄화수소 명칭 어미에 -ol 어미를 붙여 명명한다. 알코올기가 결합된 탄소의 번호가 가장 낮은 수치가 되도록 탄소번호를 붙인다. 알코올기가 결합된 탄소번호, 탄화수소 명칭, -ol의 순서로 명명한다. 알코올기가 2개면 -diol 어미를, 3개면 -triol 어미를 붙인다.
② 특성
㉮ 알코올기(hydroxy기)의 산소는 수소보다 전기음성도가 강하고 두 쌍의 고립전자쌍을 가지고 있어 음극성을 가지며, 수소는 양극성을 가진다. 그러므로 탄화수소 부분의 분자량이 크지 않으면 극성을 가지기 때문에 물에 잘 용해한다. 우리가 많이 섭취하는 포도당은 알코올기를 5개 가지고 있어 물에 잘 용해한다.
㉯ 알코올을 물에 용해하면 수소이온이 해리되어 약한 산의 성질을 가지며,물보다 더 약한 산이다. methyl alcohol과 ethyl alcohol의 해리상수는 3×10-16M이다.
㉰ 1차알코올이 산화되면 aldehyde로, 2차알코올이 산화되면 ketone으로 된다.
2) 에테르 ether
- 일반적으로 휘발성, 마취성, 인화성이 큼
- 극성이 없거나 작은 편 → 물에 작 녹지 않음
- 유기화합물과 잘 섞임
- 액체상태 에테르는 유기물질 용매로 사용
① 명칭
ether 앞에 alkyl기 혹은 aryl기의 명칭을 붙여 명명한다. 동일한 종류의 alkyl기 혹은 aryl기로 구성되어 있으면 앞에 di-를 붙여 명명한다. CH3-O-CH2CH3 (methyl ethyl ether) CH3-O-CH3 (dimethyl ether)
② 특성
산소에 두 쌍의 고립전자쌍이 존재하기 때문에 산소가 음극성이며 그 외 부위는 극성이 없다. 그러므로 수용액에서 유기물을 추출, 분리하는 용매로 사용된다. 또 비극성 부위가 크기 때문에 비극성용매로 사용한다.
3) 알데히드
① 명칭
분자구조 내에 carbonyl기가 존재하기 때문에 carbonyl화합물이라 한다. aldehyde는 탄화수소 명칭 후미에 -al 어미를 붙여 명명한다. aldehyde기가 2개인 경우 어미에 dial을 붙인다.
② 특성
㉮ carbonyl기의 산소가 탄소보다 전기음성도가 강하고 고립전자쌍을 가지기 때문에 음극성을 가지며 탄소는 양극성을 가진다. 극성을 가지기 때문에 물에 잘 용해한다.
㉯ 알데히드가 산화하면 유기산인 카르복시산(carboxylic acid)으로 된다.
㉰ 알데히드가 알코올과 반응하면 헤미아세탈(hemiacetal)이 된다. 포도당이 고리구조를 형성할 때 이와 동일한 반응에 의해서 고리구조를 형성한다.
4) 케톤
① 명칭

분자구조 내에 carbonyl기가 존재하기 때문에 carbonyl화합물이라 한다. 탄화수소 명칭 후미에 -one 어미를 붙여 명명하되 케톤기 탄소의 번호를 앞에 명기한다. 케톤기 앞뒤에 존재하는 탄화수소의 명칭을 사용하면서 어미에-ketone을 붙여 명명하기도 한다.
② 특성
㉮ aldehyde와 마찬가지로 carbonyl기의 산소가 탄소보다 전기음성도가 강하고 고립전자쌍을 가지기 때문에 음극성을 가지며 탄소는 양극성을 가진다. 극성을 가지기 때1문차에알코 물올에 잘 용해한다.
㉯ 케톤이 알코올과 반응하면 헤미케탈(hemiketal)이 된다. 이는 fructose가 고리구조를 하는 것과 동일한 현상이다.
㉰ 케톤은 고온에서 산화하는데 알데히드와는 달리 산화하여 카르복시산으로 전환되지 않고 분해된다.
㉱ 용액에 존재하는 케톤은 tautomerization에 의해 일부 케톤이 알데히드로 전환하여 평형을 유지한다.
5) 카르복시산
① 명칭, 구조 RCOOH

카르복시산은 알킬기(alkyl group)에 카르복시기(carboxyl group)가 결합되어있는 것이다. 탄화수소 명칭에 -oic acid를 붙여 명명한다. 이와 같은 체계적인 명칭 외에 통상적으로 불리던 명칭이 있는데 통상 명칭이 많이 이용된다. 카르복시기 외의 다른 작용기 혹은 가지사슬이 있는 경우에는 번호를 붙인 후, 가지사슬 혹은 작용기 탄소번호, 가지사슬 명칭 혹은 작용기 명칭, 주 골격 탄소,-oic acid의 순서로 명명한다. 탄소의 번호는 카르복시기 탄소로부터 1, 2, 3, ……의 번호를 붙이거나, 카르복시기 다음 탄소로부터 α, β, ç, ……의 순서로 번호를 붙인다. 혹은 카르복시기 탄소로부터 제일 먼 탄소로부터 Σ1, Σ2, Σ3, ……의 순서로 번호를 붙인다. 지방산의 명칭은 이 체계에 의해 명명된다.
② 특성
㉮ 카르복시기 이중결합전자의 공명현상에 의해 산소는 음극성, 탄소와 수소는 양극성을 가진다. 그러므로 카르복시기에 결합되어 있는 알칼기의 탄소 수가 4개 이하이면 물에 완전히 용해한다.
㉯ 카르복시기의 수소이온이 양극성이기 때문에 물에 용해하여 일부가 수소이온으로 해리된다. 그러므로 카르복시산은 약산이다.
㉰ 카르복시산은 염기와 반응하여 염을 생성한다. 이 염이 비누이다.
㉱ 카르복시산이 알코올과 반응하면 ester가, 암모니아와 반응하면 아미드(amide)가 생성된다.
6) 에스테르
① 명칭
ester는 카르복시산과 알코올이 축합반응에 의해 물이 한 분자 제거되면서 형성된 화합물이다. 에스테르의 명칭은 합성원료인 알코올의 알킬기 이름을 앞에, IUPAC 명칭: 2-hydroxybutanoic acid 일반명: α-hydroxybutyric acid카르복시산의 명칭의 -ic acid를 -ate로 바꾸어 표기한다. 일반명이 사용되기도 한다.
② 특성
비극성이며, 분자량이 작은 것은 휘발성이 강하여 냄새의 원인이다. 과일의 각종 향기 성분은 대부분 에스테르이다.
7) 아민, 아미드
(1) 아민

① 명칭
아민은 암모니아의 수소가 알킬기 혹은 아릴기로 치환된 것으로서, 수소 1개가 치환된 것을 1차아민, 수소 2개가 치환된 것을 2차아민, 수소가 모두 치환된것을 3차아민이라 한다. 1차아민의 치환되지 않은 암모니아분자 부분(-NH2)을 아미노기라 한다. 아미노산은 1차아민에 해당한다. 1차아민은 수소를 치환한 알칼기의 알칸 명칭의 ‘-e’ 대신에 ‘-amine’을 어미로 하여 명명하고, 아미노기가 탄소골격 중간에 결합되어 있으면 탄소의 번호를 제시한다. 탄화수소골격에 다른 원자단이 결합되어 있으면 결합되어 있는 탄소번호와 원자단의 명칭도 제시한다.
② 특성
㉮ 아민은 구조가 암모니아와 유사하므로 물과 반응하여 수소이온을 받아들이면서 OH-을 생성하는 약염기이다. 아민의 종류에 따라 염기의 세기는 다르다. 메틸아민(methylamine)과 에틸아민(ethylamine)은 암모니아보다 강한 염기이다. 암모니아의 해리상수는 1.8×10-5M이며, 메틸아민과 에틸아민의 해리상수는 각기 4.4×10-4M, 5.6×10-4M이다.
㉯ 1차아민과 2차아민은 카르복시산과 반응하여 아미드(amide)를 형성한다. 1차아민에 의해 형성된 아미드의 R과 R′ 사이의 화학결합은 단백질에서 아미노산 간의 결합인 펩티드결합에 해당한다.
(2) 아미드
① 명칭
아미드(amide)는 암모니아, 1차아민 혹은 2차아민과 카르복시산이 반응하여 생성되는 화합물로서 RCONH2, RCONHR, RCONR2의 분자식으로 표기된다. 암모니아로부터 합성된 아미드는 원료로 사용된 산의 ‘-ic acid’ 대신 ‘-amide’를 붙여 명명한다. 2차아민으로부터 합성된 아미드는 질소에 결합되어 있는 원자단을 ‘N-’을 접두어로 하여 형용사형으로 앞에 붙이고, 아미드 합성에 사용된 산의 ‘-ic acid’ 대신 ‘-amide’를 붙여 명명한다.
② 특징
㉮ 아미드는 암모니아와 아민과는 달리 염기가 아니다.
㉯ 포유동물에서 단백질 대사 부산물인 암모니아는 독성이 매우 강한데 디아미드(diamide)의 형태인 요소[(NH2)2CO]로 전환하여 배설한다. 요소는 중성으로서 생물체에 안전하기 때문에 생물체가 보호된다.
5.5. 유기화합물 이성질체
유기화합물의 이성질체
- 구조적 이성질체
- 입체 이성질체 :▷ 기하학적 이성질체 ▷ 에피머(epimer) ▷ 거울상 이성질체 ▷ 아노머(anomer)
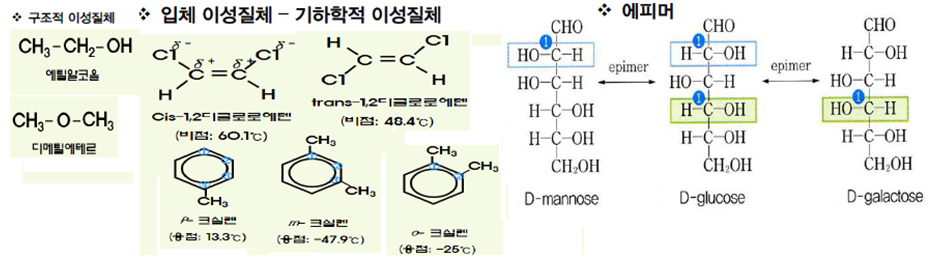
1) 구조적 이성질체(constitutional isomer)
구성 원자의 종류 및 숫자가 동일하여 분자식은 동일하지만 분자구조와 원자 단의 종류가 다른 화합물과의 관계
2) 입체 이성질체(stereoisomer)
구성 원자의 종류와 숫자, 원자단의 종류와 숫자가 다르나 이들의 입체적인 배치가 다른 유기화합물의 관계이며, 배치의 특성에 따라 기하학적 이성질체, 에피머, 거울상 이성질체, 아노머 등으로 분류한다.
(1) 기하학적 이성질체
cis/trans 이성질체, 방향족 유기화합물의 수소를 치환한 원자 혹은 원자단의 위치가 다른 이성질체를 기하학적 이성질체라 한다. cis/trans 이성질체는 탄소 간에 이중결합이 있을 때 전형적으로 나타나는 이성질체이다. 이는 다중결합이 회전을할 수 없는 것이 원인이다.
(2) 에피머
부제탄소(asymmetric carbon, 비대칭탄소, chiral 탄소) 1개의 원자 혹은 원자단의 입체 배치가 다른 이성질체를 에피머(epimer)라 한다. 부제탄소란 탄소의 4개의 화학결합에 결합되어 있는 원자 혹은 원자단이 모두 다른 탄소를 의미한다.
(3) 거울상 이성질체
대칭의 관계에 있는 이성질체를 거울상 이성질체(enantiomer) 혹은 대장체라한다. 거울상 이성질체에는 광학적 이성질체, D/L형의 이성질체가 존재한다.

① 광학적 이성질체
부제탄소를 가지고 있는 화합물은 편광을 회전시키는데 거울상 이성질체 간에는 회전방향이 반대이다. 즉 편광면을 회전시키는 방향이 다른 이성질체를 광학이성질체(optical isomer)라 하며 , 오른쪽으로 회전하는 이성질체를 우선성(d, +),왼쪽으로 회전하는 것을 좌선성(l, -)이라 한다. 두 이성질체가 동일한 양이 함께 존재하는 혼합물을 라세미 혼합물(racemic mixture)이라 하며 회전이 상쇄된다.
② D/L 형
부제탄소를 가지는 단당류와 아미노산에서 특정 작용기의 위치에 따라 D-형,L-형으로 구분한다.단당류에서는 glyceraldehyde가 기준이 되어 피셔 투영식에서 히드록시기가 부제탄소의 오른쪽에 위치하면 D-형, 왼쪽에 위치하면 L-형으로 구분한다. 부제탄소가 2개 이상인 단당류에서는 히드록시기가 알데히드기 혹은 케톤기에서 가장 멀리 있는 부제탄소의 오른쪽에 위치하면 D-형, 왼쪽에 위치하면 L-형으로 구분한다. 아미노산에서는 glyceraldehyde의 aldehyde기, 히드록시기, CH2OH를 아미노산 α-탄소의 카르복시기, 아미노기, R에 대응하는 것으로 하여 α-탄소의 왼쪽에 아미노기가 결합되어 있으면 L-아미노산, α-탄소의 오른쪽에 아미노기가 결합되어 있으면 D-아미노산이라 한다. 자연계의 단당류는 대부분 D-형이고, 자연계의 아미노산은 대부분 L-형이다. D/L형의 편광면 회전방향은 일정하지 않으며 서로 반대이다.
D/L형의 물리적·화학적 성질은 거의 유사하나 효소는 이들 이성질체를 분별하기 때문에 생체에서의 기능이 다르다.
③ 아노머
탄소가 5개 이상의 단당류에서 쇄상구조가 고리구조로 전환할 때 새로이 형성되는 부제탄소를 아노머 탄소(anomeric carbon)라 한다. 아노머 탄소의 히드록시기의 위치가 고리구조 형성에 참여한 히드록시기의 쇄상구조 때의 위치와 동일하거나 다른 입체 이성질체를 아노머(anomer)라 하며, 동일한 위치이면 α-형, 반대위치에 존재하면 β-형으로 구분한다. 단당류가 용액상태로 존재하면 두 아노머가 상호 전환하면서 존재하기 때문에 아노머가 구분되지 않으나 anomeric carbon이 화학결합에 참여하면 상호 전환되지 않기 때문에 분자구조를 포함하는 물리적·화학적 성질이 다르게 된다.

<제 5장 유기화학 정리>
⦁알칸은 비극성이기 때문에 분자 간 결합력이 대단히 약하다. 그러므로 분자량이 작은 것은 액체상태에서 기체상태로 전환하는 데 필요한 에너지가 대단히 적기 때문에 액체에서 기체로 전환되는 온도인 비점이 대단히 낮다. 알칸이
비극성이기 때문에 분자 간 결합력이 약하긴 하지만 유발쌍극자 힘이 존재하기 때문에 분자 간 결합력이 존재한다. 분자량이 크면 양성자와 전자의 숫자가 증가하기 때문에 유발쌍극자 힘도 함께 증가하고, 분자량이 커 무겁기
때문에 운동에너지가 많이 필요하다. 그러므로 액체상태에서 기체 상태로 전환되기 위해서 많은 에너지가 필요하다. 높은 온도에서 충분한 에너지를 공급받아 기체로 전환될 수 있기 때문에 분자량이 큰 알칸의 지점이 높다.
⦁에테르의 산소가 음극성이고 그 외 부위는 비극성이다. 에테르는 산소의 음극성 때문에 물에 용해할 수 있어
수용액에 널리 분포되어 있는 유기물에 접근할 수 있다. 유기물은 극성 부위와 비극성 부위를 함께 가지는데
에테르는 극성 부위와 지극성 부위를 함께 가지기 때문에 유기물들과 결합하여 물로부터 분리해 낼 수 있다.
⦁카르복시기의 수소가 강한 양극성을 가지는데, 이는 물과 같이 수소이온을 당겨 받아들일 수 있는 물질에 근접하면 일부 수소가 이온으로 해리될 수 있기 때문이다.
⦁암모니아는 염기성이기 때문에 포유동물 체액의 pH를 변화시키고 신경마비를 유발하는 독성물질이다. 그러나 아미드의 일종인 요소는 중성으로 생물체에 안전한 물질이기 때문에 암모니아를 요소로 전환시킴으로써 암모니아에 의한 pH 변화와 신경마비의 문제를 방지할 수 있다.
⦁생물체에서의 대사반응은 효소에 의해 이루어지는데 효소는 거울상 이성질체를 분별할 수 있기 때문에 거울상 이성질체의 생물체에서의 기능이 동일하지 않을 수 있다.
⦁탄소 간 결합은 공유결합이기 때문에 안정하다. 탄소의 전기음성도가 중간이기 때문에 여러 가지 원자와 공유결합이 가능하고, 탄소원자 1개가 4개의 화학결합을 할 수 있기 때문에 다양한 구조의 분자를 형성할 수 있다.
⦁분자량, 기하학적 구조, 구성 원자의 종류가 다른 것이 이유일 수 있으나 유기화합물 기능의 결정적인 원인은 작용기이다.
⦁포도당은 알데히드기와 히드록시기를 가지며 케톤기는 가지지 않는다. 알데히드기가 극성을 가지기 때문에 수용성에 기여하긴 하지만 히드록시기가 5개 존재하기 때문에 높은 수용성은 히드록시기에 기인한다.
⦁산소가 탄소와 수소보다 전기음성도가 매우 강하기 때문에 이중결합 전자가 공명상태에서 주로 산소 쪽에 근접하여 존재하므로 산소는 음극성, 탄소와 수소는 양극성을 가진다.
⦁거울상 이성질체는 동일한 종류의 화합물의 D/L 이성질체이다.
(요약)
유기화합물의 특성 :
①탄소-탄소 결합이 공유결합→매우 안정 ②탄소의 전기음성도가 중간
③탄소의 원자가전자가 4개→골격모양이 다양, 단일결합, 다중결합 가능 ④탄소화합물에 특정 작용기가 결합-생물체 고유 기능
유기화합물
탄화수소 지방족탄화수소 알칸, 알켄, 알킨, 고리형, 방향족탄화수소
탄화수소-작용기 알코올(히드록기), 에테르, 알데히드(카보닐기), 케톤(카보닐기), 카르복시산(알킬기+카르복시시),에스테르,아민, 아미드
-알칸 :
①불포화결합을 가지지 않는 지방족탄화수소 ②작용기 없고
③모두 시그마결합→화학반응성 매우 약함 ④연료들은 모두 알칸의 혼합물
-알켄, 알킨 : 이중결합(알켄), 삼중결합(알킨), 반응성은 알칸보다 크다, 첨가반응
-방향족 탄화수소 : 기본구조 벤젠, 공명, 반응성 알켄보다 적다. 치환반응
-알코올(히드록기) :
①산소-음극성, 수소-양극성, 물에 잘 용해, ②포도당(히드록기 5개→물에 잘 용해) ③약한 산
- 에테르 :
①산소-음극성, 그 외는 무극성→수용액에서 유기물을 추출, 분리하는 용매로 사용, ②비극성용매로 사용
- 알데하이드 :
①산소-음극성, 탄소-양극성,→물에 잘 용해, ②카르보닐화합물, ③산화→카르복시산, ④알데하이드+알코올→헤미아세탈
- 케톤 :
①산소-음극성, 탄소-양극성,→물에 잘 용해, ②카르보닐화합물, ③산화→분해, ④케톤+알코올→헤미아세탈
- 카르복시산 :
①산소-음극성, 탄소와 수소는 양극성, 이중결합전자의 공명현상 → 반응성 ②알킬기+카르복시기,
③알칼기의 탄소수가 4개이하 이면 물에 완전 용해, ④약산, 염기와 반응하여 염을 생성,
⑤카르복시산+알코올→에스테르, ⑥카르복시산+암모니아→아미드
- 에스테르 :
①카르복시산+알코올(축합반응)→물+에스테르, ②비극성, ③휘발성, 냄새의 원인, 과일 향기
- 아민 :
①암모니아의 수소가 알킬기 혹은 아릴기로 친환된 것, ②아미노산은 1차 아민, 약염기, ③ 펩티드결합
- 아미드 :
①1차 아민과 2차 아민은 카르복시산과 반응하여 아미드 형성된 화합물,
②염기가 아니다→암모니아를 아미드형태인 요소로 배설→생물체 보호
- 유기화합물 이성질체
구조적이성질체 : 분자식 동일, 분자구조와 원자단 종류 다름
입체적 이성질체 : 기하학적, 에피머, 거울상(광학적, D/L형, 아노머)
- 효소는 거울상 이성질체를 구분할 수 있음.
E 연습문제
1. 분자량이 작은 알칸은 비점이 대단히 낮고, 분자량이 큰 알칸은 비점이 매우 높은 이유는 무엇인가?
→ 알칸은 비극성이기 때문에 분자 간 결합력이 대단히 약하다. 그러므로 분자량이 작은 것은 액체상태에서 기체상태로 전환하는 데 필요한 에너지가 대단히 적기 때문에 액체에서 기체로 전환되는 온도인 비점이 대단히 낮다. 알칸이 비극성이기 때문에 분자 간 결합력이 약하긴 하지만 유발쌍극자 힘이 존재하기 때문에 분자 간 결합력이 존재한다. 분자량이 크면 양성자와 전자의 숫자가 증가하기 때문에 유발쌍극자 힘도 함께 증가하고, 분자량이 커 무겁기 때문에 운동에너지가 많이 필요하다. 그러므로 액체상태에서 기체상태로 전환되기 위해서 많은 에너지가 필요하다.높은 온도에서 충분한 에너지를 공급받아 기체로 전환될 수 있기 때문에 분자량이 큰 알칸의 비점이 높다.
2. 에테르가 수용액에서 유기물을 추출하는 용매로 적당한 이유는 무엇인가?
→ 에테르의 산소가 음극성이고 그 외 부위는 비극성이다. 에테르는 산소의 음극성 때문에 물에 용해할 수 있어 수용액에 널리 분포되어 있는 유기물에 접근할 수 있다. 유기물은 극성 부위와 비극성 부위를 함께 가지는데 에테르도 극성 부위와 비극성부위를 함께 가지기 때문에 유기물들과 결합하여 물로부터 분리해 낼 수 있다.
3. 카르복시산이 약산일 수 있는 이유는 무엇인가?
→ 카르복시기의 수소가 강한 양극성을 가지는데, 이는 물과 같이 수소이온을 당겨 받아들일 수 있는 물질에 근접하면 일부 수소가 이온으로 해리될 수 있기 때문이다.
4. 포유동물에서 단백질 대사 부산물인 암모니아가 요소로 전환될 때의 이점은 무엇인가?
→ 암모니아는 염기성이기 때문에 포유동물 체액의 pH를 변화시키고 신경마비를 유발하는 독성물질이다. 그러나 아미드의 일종인 요소는 중성으로 생물체에 안전한 물질이기 때문에 암모니아를 요소로 전환시킴으로써 암모니아에 의한 pH 변화와 신경마비의 문제를 방지할 수 있다.
5. 거울상 이성질체는 물리적·화학적 특성이 동일하지만 생물체 내에서는 기능이 다른 이유는 무엇인가?
→ 생물체에서의 대사반응은 효소에 의해 이루어지는데 효소는 거울상 이성질체를 분별할 수 있기 때문에 거울상 이성질체의 생물체에서의 기능이 동일하지 않을 수 있다.
1. 유기화합물이 생물체에서 가지는 역할에서 탄소가 구조의 골격을 구성하고 있는것에 기인하는 점은?
→해설 탄소 간 결합은 공유결합이기 때문에 안정하다. 탄소의 전기음성도가 중간이기 때문에 여러 가지 원자와 공유결합이 가능하고, 탄소원자 1개가 4개의 화학결합을 할 수 있기 때문에 다양한 구조의 분자를 형성할 수 있다.
2. 탄수화물, 지질, 단백질, 비타민, 핵산 등이 생물체에서 각기 다른 고유한 기능을 가질 수 있는 가장 중요한 원인은?
→ 해설 분자량, 기하학적 구조, 구성 원자의 종류가 다른 것이 이유일 수 있으나 유기화합물 기능의 결정적인 원인은 작용기이다.
3. 포도당이 물에서 용해도가 높은 원인에 해당하는 것은?
→해설 포도당은 알데히드기와 히드록시기를 가지며 케톤기는 가지지 않는다. 알데히드기가 극성을 가지기 때문에 수용성에 기여하긴 하지만 히드록시기가 5개 존재하기 때문에 높은 수용성은 히드록시기에 기인한다.
4. 카르복시산이 반응성을 가지는 원인에 해당하는 것은?
→해설 산소가 탄소와 수소보다 전기음성도가 매우 강하기 때문에 이중결합 전자가 공명상태에서 주로 산소 쪽에 근접하여 존재하므로 산소는 음극성, 탄소와 수소는 양극성을 가진다.
5. 다음 중 거울상 이성질체의 관계인 것은?
① D-glucose, D-fructose ② cis-1,2-dichloroethene, trans-1,2-dichloroethene
③ D-galactose, L-galactose ④ o-xylene, p-xylene
정답 ③
[연습문제]
1. 유기화합물이 안정한 이유의 원인이 되는 원자는 무엇이며, 안정성의 원인은 무엇인가?
☞안정성의 원인이 되는 원자 : 탄소
※안정성의 원인 : 탄소의 전기음성도가 2.5로서 중간이므로 여러 원자와 공유결합을 할 수 있음.
2. 알켄이 알칸보다 화학반응성이 큰 원인 성분과 그 이유는 무엇인가?
☞원인성분 :알켄의 이중결합의 파이결합을 하고 있는 파이결합 전자 알칸의 결합은 모두 시그마 결합이고, 알켄의 결합은 시그마 결합과 파이 결합을 하고 있다.
시그마 결합 전자는 원자의 핵과 가까이 분포되어 이동성이 적고, 파이결합 전자는 원자의 핵과 먼 거리에 분포되어 있어 이동성이 크다. 일반적인 화학반응에는 전자의 이동이 중요한 위치를 담당하고 있는데 알켄에는 이동성이 좋은 파이전자가 존재하기 때문에 반응성이 알칸보다 높다.
3. 포도당이 물에 잘 용해하는 원인은 무엇인가?
☞포도당의 히드록시기
※히드록시기는 산소가 음극성을 수소가 양극성을 가지고 있어 물과 수소결합을 잘한다.
포도당은 히드록시기가 분자 당 5개 가지고 있기 때문에 물에 잘 용해한다.
4. 케톤은 온화한 일반적인 조건에서 산화되지 않음에도 불구하고 환원 기능이 있는 이유는 무엇인가 ?
※용액 상태에서 tautomerization에 의해 케톤의 일부가 알데히드로 변화하기 때문이다.
5. 거울상이성질체의 물리, 화학적 특성은 거의 유사하지만 생물체에서는 다른 기능을 가지는 이유는 무엇인가?
※생물체의 대사반응은 효소에 의해 진행되며, 효소가 거울상이성질체를 정확하게 분간하기 때문이다
6. 일반적으로 사람이 과일향 냄새를 잘 느낄 수 있는 이유와 관련된 작용기는 무엇인가?
1] 에테르 2] 카르복시산 3] 알코올 4] 에스테르
※에스테르는 비극성으로 물에 용해되지 않고 분자량이 적은 것은 휘발성이 강하며, 대부분의 과일향은 에스테르 성분이 원인이다.
※ 부족하지만 글의 내용이 도움이 조금이라도 되셨다면, 단 1초만 부탁드려도 될까요? 로그인이 필요없는 하트♥(공감) 눌러서 블로그 운영에 힘을 부탁드립니다. 그럼 오늘도 행복한 하루 되십시오^^
'농업생물화학' 카테고리의 다른 글
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 7. 세포 (7) | 2022.11.25 |
|---|---|
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 6. 생체물질 (3) | 2022.11.24 |
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 4. 수용액의 화학 (8) | 2022.11.22 |
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 3. 화학반응 (3) | 2022.11.21 |
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 2. 화학결합 (7) | 2022.11.20 |