2. 화학결합

⦁원자가 전자 : 화학결합에 참여하는 최외각 전자
⦁이온화 에너지(ionization energy) : 원자에서 전자를 이탈시키기 위해 가해야 하는 에너지,원자에 존재하는 전자를 제거하는데 가해야 하는 에너지
⦁전자친화도(electron affinity) : 원자에 전자가 첨가될 때 방출되는 에너지 크기의 정도
⦁전기음성도(electronegativity) : 원자가 전자를 끌어당기는 정도를 표현하는 척도,원자로부터 전자가 이탈할 때 방출되는 에너지
⦁이온결합(covalent bond) : 음전하 물질과 양전하 물질이 정전기적 인력에 의해 형성되는 화학결합,양이온과 음이온간의 정전기적 인력에 의해 형성된 화학결합
⦁공유결합(covalent bond) : 두 물질이 전자를 공유하면서 형성되는 화학결합, 전자를 공유하면서 형성된 화학결합
⦁배위공유결합(coordinate covalent bond) : 한 물질이 제공하는 전자만을 공유하면서 형성되는 화학결합,한개의 원자로부터만 전자쌍이 공급되면서 형성된 공유결합
⦁고립전자쌍(lone pairs) : 화학결합에 참여하지 않는 원자가전자쌍
⦁팔전자 규칙(octet rule) : 공유결합을 하여 최외각궤도의 전자가 8개가 되어 불활성기체와 동일한 전자배치를
하고자 하는 경향
⦁단일결합(single bond) : 전자 한 쌍(2개)을 공유하면서 형성되는 공유결합
⦁이중결합(double bond) : 전자 두 쌍(4개)을 공유하면서 형성되는 공유결합
⦁삼중결합(triple bond) : 전자 세 쌍(6개)을 공유하면서 형성되는 공유결합
⦁극성공유결합(polar covalent bond) : 공유결합에 참여하는 전자가 두 원자 사이의 중앙에 존재하지 않고 한쪽 원자로 치우쳐져 있어 극성을 띠면서 형성된 공유결합. 공유되는 전자가 완전하게 공유되지 않고 한쪽 원자로 치우쳐서 형성된 공유결합
⦁혼성궤도함수(hybrid atomic orbital) : 궤도의 형태가 다른 원자가전자들이 다른 원자들의 전자와 동일한 여러
개의 공유결합을 하기 위해 변화하여 형성한 궤도함수
⦁원자가전자쌍 반발이론(valence shell electron pair repulsion theory) : 루이스 구조식에서 나타나는 중심원자의 각 원자가전자쌍들은 서로 반발하므로 서로 가장 멀리 떨어진 위치에 존재하게 된다는 것에 기초하여 분자의 구조를 예측하는 이론
⦁쌍극자-쌍극자 힘(dipole-dipole force): 반대 극성의 분자 간 인력
⦁유발쌍극자 힘(induced dipole-dipole force) : 비극성분자에 극성분자가 접근하면서 비극성분자 내 전자분포
균형이 깨지면서 형성된 극성이 원인이 되어 일어나는 반대 극성분자 간 인력
⦁수소결합(hydrogen bond) : 공유결합에 참여하고 있는 수소의 양극성이 원인이 되어 형성되는 분자 간 화학결합
⦁런던 분산력(London disposal force) : 비극성분자 내 전자분포의 일시적인 불균형에 의해 형성되는 극성에
기인하는 분자 간 인력
⦁반데르발스 힘(van der Waals force) : 쌍극자-쌍극자 힘, 유발쌍극자 힘, 수소결합, 런던 분산력을 통틀어서 일컬음. 분자간에만 존재하는 결합으로서 쌍극자-쌍극자 힘, 수소결합, 유발쌍극자 힘, 런던 분산력이 해당한다.
[학습개요]
⦁원자들은 불활성기체를 제외하고는 대부분 자연계에서 원자 간에 화학결합을 하여 다원자 분자의 형태로 존재하며, 원자간 화학결합이 분자의 특성에 큰 영향을 미친다. 화학반응은 물질들이 서로 결합하거나 분해되어 새로운 물질을 형성하는 과정이다. 결합하여 새로운 물질을 형성한다고 하는 것은 화학결합이 형성되는 것이며, 분해된다고 하는 것은 화학결합이 분해되는 것이다. 그러므로 자연현상을 이해하기 위해서는 화학결합을 잘 이해해야 한다.
⦁화학결합의 종류는 결합에 참여하는 원자 및 분자를 구성하는 전자들의 존재 양태에 기인하는 특성에 의해 결정된다. 그 특성은 원자의 이온화에너지, 전자친화도, 전기음성도, 이온성, 극성 등이다. 원자 간에는 이온결합과 공유결합, 분자 간에는 이온결합, 공유결합, van der Waals힘 에 의해 화학결합이 가능하다.
|
화학결합
|
형태
|
|
원자간
|
공유결합, 이온결합,
|
|
분자간
|
공유결합, 이온결합, 반데르발스 힘
|
2.1 원자 특성과 전자배치
⦁ 화학결합 원인 : 엔트로피 증가, 에너지 함량 감소, 안정화
⦁ 화학결합과 원자 특성
- 원자의 전자 배치 양태와 원자의 특성
- 이온화에너지, 전자친화도, 전기음성도
2.1.1 원자 크기
㉮ 주기율표상의 동일 족에서는 주기가 증가할수록 전자껍질 수가 많아지기 때문에 원자 반지름이 증가한다.
- 주기(동일한 주양자수(전자껍질))가 증가하면서 최외각 전자껍질이 핵으로부터 멀어지면서 원자의 반지름이 증가한다.
㉯ 주기율표상의 동일한 주기에서는 족이 증가하면 양성자와 전자의 숫자가 많아지고 상호 인력이 커지기 때문에 원자의 반지름은 감소한다. 원자 반지름이 작으면 양성자가 외부 전자에 미치는 인력이 강하기 때문에 전자를 얻어 음이온으로 전환하기 쉽다.
⇒ 동일한 주기에서 반지름이 큰 원자일수록 양성자가 외각 전자에 미치는 인력이 작아 전자가 이탈하기 쉽고, 반지름이 작을수록 양성자가 외각 전자에 미치는 인력이 커 전자를 잃기 어려울 뿐만 아니라 전자를 얻기 쉽다
2.1.2 이온화 에너지
㉮ 안정한 바닥상태의 원자의 전자를 이탈시키는데 가해야 하는 에너지를 이온화 에너지라 하며, 이온화 에너지가 적은 전자는 제거되기가 쉽다.
㉯ 원자 반지름이 크면 양성자와 전자 간의 인력이 약하므로 전자가 이탈하여 양이온으로 전환하기 쉽다. 그러므로 Ⅰ족, Ⅱ족 원소들은 전자를 잃고 양이온으로 전환되기 쉽다.
㉰ 전자의 이온화 에너지는 전자가 원자로부터 쉽게 제거될 수 있는지 혹은 아니지를 나타내기 때문에, 원자의 양이온으로의 전환 가능성을 판단할 수 있는 지표이다
㉱ 원자번호가 증가할수록 양성자수가 증가하기 때문에 원자핵의 양성자에 의한 인력이 증가하므로 전자를 제거하기 위해 필요한 이온화 에너지는 증가한다. 그러므로 동일주기의 IA족 원소는 전자가 쉽게 제거되고 VIIIA족 원소는 전자를 잃는 것이 거의 불가능하다.
2.1.3 원자의 전자친화도
㉮ 원자에 전자가 첨가, 결합될 때 에너지가 방출되는 정도를 전자친화도로 표현하며 방출되는 에너지가 클수록 전자친화도가 커 전자를 잘 받아들인다.
㉯ 원자 반지름이 작으면 양성자가 외부 전자에 미치는 인력이 강하기 때문에 전자를 얻어 음이온으로 전환하기 쉽다. 그러므로 Ⅶ족 원소들은 전자를 받아 음이온으로 전환되기 쉽다.
㉰ 전자가 첨가될 때 에너지가 방출되면 원자의 에너지가 감소하는 것이 때문에 전자친화도는 음수값으로 표현된다. 전자친화도가 음수로 큰원자는 전자를 받기 쉽고 음이온으로 전환되는 성향이며 “전자친화도가 크다“고 한다. 전자를 받아들이는 성향을 나타내기 때문에 원자가 음이온으로 전환되는 성향을 판단하는 지표이다.
㉱ 동일한 주기에 원자번호가 증가할수록 핵의 전자에 대한 인력이 증가하기 때문에 전자친화도의 음수값이 증가한다.
2.1.4 전기음성도
㉮ 전기음성도는 원자가 전자를 당기는 힘의 척도(상대적인 개념)로서 원자의 반지름, 전자의 이온화 에너지, 원자의 전자친화도가 종합된 특성이다. 그러므로 주기율표상에서 불활성기체를 제외한 원자들 중에서 우상단에 위치하는 원자들의 전기음성도가 크다.
- 전기음성도가 크면 전자를 끌어당기는 힘이 크다.
㉯ 폴링이 제안한 전기음성도가 일반적으로 많이 이용된다. 공유결합을 하고 있는 두 원자 간에 전자가 완전히 공유되었다고 가정했을 때의 이론상의 해리에너지와 실제 해리에너지의 차이에 의해 두 원자 간 전기음성도의 상대적인 차이를 계산해 낼 수 있다. 이와 같은 실험에 의해 구해진 전기음성도의 상대적인 차이에 근거하여 모든 원자들의 전기음성도를 결정한 것이 폴링의 전기음성도이다.
㉰ 주기율표의 오른쪽, 상단에 위치하는 전자일수록 전기음성도가 크고, 주기율표의 왼쪽, 하단에 위치하는 원자일수록 전기음성도가 작다. 불활성기체에는 전자를 당시는 힘이 존재하지 않는다.
- 전이원소들을 제외하고는 전기음성도는 원자의 반지름, 이온화에너지, 전자친화도의 경향과 유사하다. 원자 반지름이 작고, 소유하고 있는 전자의 이온화 에너지가 크고 전자친화도가 음수값으로 큰 원자는 전기음성도가 크다. 상대적 개념으로 단위가 없다.
2.2 원자 간 화학결합
- “자연계에서 대체로 안정해지려는 경향이 있다” 독립적으로 존재하는 원자가 불안정한 경우 다른 원자와 화학결합을 하여 안정해 질 수 있는 것이 분자를 형성하게 한 원인이다.
2.2.1 이온결합
㉮ 양이온과 음이온이 근접할 때 정전기적 인력에 의해 형성되거나, 전기음성도의 차이가 큰 원자가 근접할 때 전자가 이동하면서 이온을 형성하여 정전기적 인력에 의해 이온결합이 형성된다.
㉯ ⅠA, ⅡA족 원자와 ⅦA족 원소 간에 이온결합이 주로 형성된다.
2.2.1.1 이온의 형성
- 전자를 잃기 쉽거나 전자를 얻기 쉬운 특성이 있는 원자가 전자의 이동을 유발하는 환경에 있을 때 전자를 잃거나 얻어 이온으로 전환된다
- 양이온은 원자에서 전자 제거됨으로써 형성된다.
2.2.1.2 이온결합의 형성
① 양이온과 음이온이 접근하는 경우
- 양이온과 음이온이 접근해 정전기적 인력에 의해 서로 강하게 끌려 일정한 거리 이상을 벗어나지 못하게 되면 이온결합이 형성된다. 이온들의 전하가 클수록, 거리가 가까울수록 증가한다
② 전기음성도의 차이가 매우 큰 원자들이 접근하는 경우
- 전기음성도의 차이가 매우 큰 원자들이 접근하면 전기음성도가 작은 원자로부터 전자가 전기음성도가 큰 원자로 이동하여 양이온과 음이온을 형성하면서 이온결합을 형성한다.
- 이온성화합물은 여러개가 집단으로 존재하는 경우에는 분자들이 가진 전하 때문에 독립된 분자로 존재하지 안호 상호결합하여 결정격자를 형성한다. 그러므로 이온성화합물의 분자식은 개별 분자의 우너자 구성을 나타내는 것이 아니고 해당 화합물 집단에 전재하는 원자의 비율을 의미한다. 그러므로 이온성화합물에서는 분자식이라는 용어 대신 화학식을 사용한다.
- 화학결합을이 형성될 때 이동한 전자는 최외각 궤도의 전자이고, 이동한 전자가 새로운 원자에 자리 잡는 위치도 최외각 궤도이기 때문에 표기하는 전자는 최외각 궤도의 전자, 원자가전자이다
2.2.2 공유결합
- 전기음성도가 동일하거나 유사한 원자들 간에는 전자가 이동하지 않고 공유된 상태에서 화학결합이 형성된다.

(공유결합은 전자가 한 원자로 이동하지 않고 공유되면서 결합이 형성되기 때문에 결합에 참여하는 원자들의 전기음성도가 동일하거나 유사하다)
2.2.2.1 공유결합의 형성
- 공유결합에서 공유되는 전자쌍은 양쪽 원자의 핵에 의해 동시에 끌리게 되고, 이 인력이 두 원자를 붙잡고 있으면서 분자를 형성하는 것이다.
- 공유결합에 참여하지 않는 원자가전자가 존재하는 이를 비결합전자 혹은 전자를 2개씩 묶어 고립전자쌍이라고도 한다.

- 전자를 공유하여 불활성기체인 ⅧA 원소들과 동일한 전자배치를 하는 경우가 많다. ⅧA 원소들은 He을 제외하고는 모두 최외각에 8개의 전자를 가지기 때문에 불활성기체와 동일한 전자구조를 하고자 하는 경향에 의해 화학결합이 형성되는 것을 팔전자 규칙이라 한다(공유결합을 하여 최외각전자가 8개개 되고자 하는 경향). 그러나 팔전자 규칙이 모든 경우에 다 옳게 적용되는 것이 아니고 예외가 있다.
2.2.2.2 팔전자 규칙의 예외
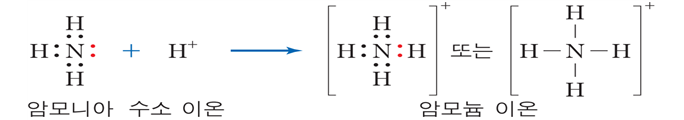
(배위 결합)한 원자가 다른 원자에게 비공유 전자쌍을 일방적으로 제공하여 이루어지는 공유 결합
▶ 예) H3O+, SO42-, NH4+, NO3-, BF3NH3 등
① 수소 이온과 비공유 전자쌍을 가진 분자 사이의 결합
암모니아의 질소 원자가 수소 이온에게 일방적으로 비공유 전자쌍을 제공하여 형성됨
② 옥텟을 이루지 못한 분자와 비공유 전자쌍을 가진 분자 사이의 결합
삼플루오린화 붕소는 암모니아에 있는 비공유 전자쌍을 일방적으로 제공받아 옥텟 규칙을 만족시킴
2.2.2.3 공유결합의 종류
- 고유결합에 공유된 전자의 수에 따라 공유결합을 단일,이중,삼중경합으로 분류한다
2.2.2.3.1 단일결합, 다중결합
① 단일결합
전자 한 쌍(2개)을 공유하면서 형성된 화학결합이며, 이 화학결합은 시그마결합이다. 시그마결합(sigma bond)이란 두 원자가 제공하는 전자들이 각 원자에서 상대 원자 방향으로 분포하면서 중첩하여 형성되는 결합이다.
② 다중결합
전자 두 쌍(4개)을 공유하면서 형성된 화학결합을 이중결합, 전자 세 쌍(6개)을 공유하면서 형성된 화학결합을 삼중결합이라 한다. 이중결합에서 각 원자가 제공하는 1개씩(2개)의 전자들은 시그마결합을 한다. 다른 1개씩(2개)의 전자들은 화학결합과 수직으로 운동하면서 전자구름을 형성하는 상태에서 중첩하여 화학결합이 형성된다. 이를 파이결합(pi bond)이라 한다. 삼중결합에서는 각 원자가 제공하는 1개씩(2개)의 전자는 상호 시그마결합을 하고 다른 2개씩(4개)의 전자들은 각기 2개의 파이결합을 한다..

2.2.2.3.2 극성공유결합
① 극성공유결합
전기음성도가 동일하지 않은 원자 간에 공유되는 전자가 한 원자에 더 근접해 존재할 때 각 원자들이 음극성, 양극성을 띠면서 공유결합을 한다. 이를 극성공유결합이라 한다. 그러나 형성되는 화학결합이 대칭이면 원자들의 전기음성도가 다르다 해도 극성이 형성되지 않는다.

- 전기음성도가 동일하지 않고 다소의 차이가 있는 두 원자간의 공유결합에서는 공유의 공평성이 유지되지 않고 전자는 전기음성도가 큰 원자로 치우쳐 다소의 전하분리가 일어난다. 이때 전기음성도가 큰원자는 음극성을, 전기음성도가 작은원자는 양극성을 띄게 된다. 이와같이 완전한 공유결합과 이온결합의 중간 정도의 전기적 성질, 즉 극성을 가지면서 공유결합을 하는 것을 극성공유결합(polar covalent bond)라 한다. 다른(상이한) 원자간의 공유결합은 대부분 극성공유결합이다. 극성분자의 극성은 분자간 화학결합을 형성하여 집단을 형성하게 하는 원인이 된다.
- 그러나 다른 원자로 구성된 분자의 경우라도 전자의 인력이 작용하는 방향이 대칭을 이루는 때에는 극성이 형성되지 않는다. H2O 경우 결합각이 104.5도이고 공유되는 전자가 전기음성도가 큰 산소쪽으로 치우쳐 산소가 음극성을 수소는 양극성을 가진다
② 공유결합들 간의 세기
다중결합에는 시그마결합 외에 파이결합이 존재하기 때문에 결합의 세기는 다음과 같다.
단일결합<이중결합<삼중결합 (공유되는 전자의 수가 많을수록 결합의 세기가 강하다)
2.2.2.4 궤도함수의 중첩
- 전자를 공유하면서 결합을 한다고 하는 것은 공유되는 각 전자들의 전자구름이 중첩되는 현상이다. HF분자에서 H의 1s 궤도함수와 F의 한 2p 궤도함수와의 중첩 H2분자에서 1s 궤도함수들의 중첩한 원자가 2개 이상의 다른 원자와 동일한 종류의 공유결합을 할 때 각 원자의 전자들이 상이한 궤도를 가질 수 있다. 이러한 경우 상이한 궤도를 가지는 것들이 중첩하여 동일한 종류의 공유결합을 한다고 할 수 없다. 이러한 경우 한 원자의 전자들의 궤도함수가 혼성되어 모두 동일한 궤도함수를 가진 후에 화학결합을 하여 동일한 종류의 공유결합을 할 수 있게 된다.

2.2.2.5 궤도함수의 혼성
- 혼성궤도함수 : 궤도의 형태가 다른 원자가전자들이 다른 원자들의 전자와 동일한 여러개의 공유결합을 하기위해 변화하여 형성한 궤도함수
2.2.2.5.1. 단일결합을 위한 궤도함수의 혼성
- 탄소가 화학결합을 하는 경우에는 필요에 따라 원자가전자의 존재 양태가 변화하여 적절한 궤도함수로 변화한다.

2.2.2.5.2. 이중결합을 위한 궤도함수의 혼성
- 이중결합에 참여하는 전자 2개중에 1개는 단일결합과 동일하게 결합에 참여하지만 나머지 1개는 단일결합과 다른 양태로 결합에 참여한다.
- 시그마결합에 참여하는 전자들은 탄소의 핵과 수소의 핵사 사이의 축 혹은 탄소의 핵과 다른 탄소의 핵 사이의 축 사이에 밀집되어 있어 핵과의 인력이 강하게 작용한다. 그러나 파이결합 전자들은 핵 사이의 축에서 멀리 존재하기 때문에 핵과의 인력이 약하다. 그러므로 파이결합 전자들은 시그마결합 전자들보다 자유로워 반응에 참여하기가 용이하다. 이러한 이유 때문에 시그마결합만으로 구성되는 포화결합 탄소화합물보다 파이결합 전자를 가지는 불포화 탄소화합물의 반응성이 더 크다.
2.2.2.5.3. 삼중결합을 위한 궤도함수의 혼성
- 탄소원자의 삼중결합을 위한 궤도함수의 혼성은 이중결합의 경우와 유사하나 sp혼성궤도함수를 형성하고 파이결합이 2개라는 것이 상이하다. 삼중결합은 파이결합 전자를 두 쌍 가지고 있기 때문에 단일결합, 이중결합의 화합물 보다 반응성이 강하다.
2.2.3 분자의 기하학적 구조
- 원자 간 화학결합의 각도와 길이에 근거하여 구조가 결정된다. 이때 중심원자주변의 모든 원자가전자쌍들은 상호 배척하여 서로 멀리 존재하면서 분자의 구조에 큰 영향을 미친다. 이를 원자가전자쌍 반발이론이라 하며, 이에 근거하여 분자의 구조를 상당한 정도로 정확하게 예측할 수 있다.
⦁ 분자의 기히학적 구조는 분자를 구성하는 원자들의 삼차원적 배치에 의해 결정되며, 이는 원자가전자의 존재양태에 의한 분자의 극성을 좌우하기 때문에 녹는점, 밀도, 분자가 수행하는 반등 등과 같은 분자의 물리학적, 화학적 특성에 영향을 미친다. 분자의 기하학적 구조,즉 분자의 모양은 구성원자 간의 결합길이와 결합각에 의해 결정된다.
⦁ 원자전자쌍 반발이론(valence shell electron pair repulsion theory)에 의해 분자의 모양을 거의 정확하게 예측할 수 있다. 이 이론은 분자의 중심에 존재하는 원자 주위의 모든 원자가전자쌍은 서로 반발하기 때문에 반발을 최소화할 수 있도록 가능한 멀리 떨어쟈 있다는 가정하에서 출발한다.
2.3 분자 간 결합
- 분자 간에 가능한 결합은 이온결합, 공유결합 외에 반데르발스 힘(쌍극자-쌍극자 힘, 수소결합, 런던 분산력, 유발쌍극자 힘) 등이 있다. 분자 간 결합은 분자의 융점, 비점, 증발열 등 물리적 특성에 크게 영향을 미친다.
화학결합들의 세기는 공유결합>이온결합>수소결합>쌍극자-쌍극자 힘>유발쌍극자 힘·런던 분산력의 순서이다.
2.3.1 쌍극자-쌍극자 힘
- 극성공유결합에 의해 형성된 분자들의 양극성 부위와 음극성 부위 간의 결합
⦁ 전기음성도가 동일하지 않은 원자로 구성된 공유결합분자는 극성을 상쇄하는 기하학적 대칭구조를 가면 극성이 없으나, 극성이 상쇄되지 않는 구조이면 분자 내에서 전자분포의 불균형으로 인하여 양극성과 음극성을 가진다. 이를 쌍극자라 하고, 극성분자가 이에 해당한다. 쌍극자의 분자들이 근접하여 존재하면서 서로 다른 극성 부위끼리 당기는 힘이 생기는데 이를 쌍극자-쌍극자 힘이라 하며 극성분다들이 집단을 형성하는 원인이 된다. SO2분자는 황이 양극성을, 산소가 음극성을 가지면서 SO2의 황과 다른 SO2의 산소가 근접하면 쌍극자-쌍극자 인력으로 결합한다.
2.3.2 수소결합
- 수소가 전기음성도가 큰 원자와 결합하여 분자를 형성하게 되면 수소는 1개뿐인 전자를 거의 잃어버린 꼴이 되어 강한 양극성을 가지게 된다. 음극성을 가지는 분자는 이러한 수소를 매개로 하여 분자 간에 결합을 할 수 있으며 이를 수소결합이라 한다. 물분자들은 상호 수소결합을 하고 있는데 수소결합력은 반데르발스 힘 중에서 제일 강한 결합이다. 그러므로 물은 유사한 분자량의 다른 물질과 비교할 때 융점, 비점이 높고, 증발열이 크다.
⦁ 수소가 전기음성도가 매우 큰 N, O, F와 같은 원자와 공유결합을 하는 경우에 수소의 전자가 전기음성도가 큰 원자로 치우쳐 존재한다. 수소는 전자가 1개이기 때문에 이와같은 공유결합을 함으로써 전자를 거의 가지고 있지 않은 상태가 되어 매우 강한 양극성을 갖게된다. 이러한 강한 양극성을 가지는 수소는 다른 극성분자의 음극성과 강하게 결합할 수 있는 매개체가 된다. 수소결합은 쌍극자-쌍극자 힘의 특수한 예로서 다른 극성분자들의 쌍-쌍 힘보다 매우 강하기 때문에 별도의 결합으로 취급한다.
2.3.3 런던 분산력
- 원자 간에 전자가 치우침 없이 공유되어 극성을 전혀 가지지 않는 분자라 해도 전자는 항상 운동을 하기 때문에 순간적으로 전자의 쏠림현상이 생겨 극성을 가질 수 있다. 이러한 극성에 의해 분자 간에 약하긴 하지만 결합이 형성될 수 있다. 이를 런던 분산력이라 한다.
2.3.4 유발쌍극자 힘
|
화합물
|
분자량
|
융점(℃)
|
비점(℃)
|
증발열
(cal/g)
|
분자 간 결합
|
|
H2O
|
18
|
0
|
100
|
540
|
수소결합
|
|
NH3
|
17
|
-75
|
-33
|
327
|
수소결합
|
|
CH4
|
16
|
-183
|
-59
|
138
|
런던분산력
|
|
Ne
|
20
|
-249
|
-246
|
22
|
럳넌분산력
|
- 원자 간에 전자가 치우침 없이 공유되어 극성을 전혀 가지지 않는 분자라 해도 극성을 가지는 분자가 근접하면 전자의 분자 내 균형이 깨져 극성을 형성하면서 다른 분자와 화학결합을 할 수 있다. 이를 유발쌍극자 힘이라 한다.
2.3.5 분자 간 결합과 물리적 특성
- 분자들 사이에 작용하는 결합력은 물질릐 휘발성, 융점, 비점, 증발열 등의 물리적 성질에 영향을 미치며, 결합의 세기에 따라 그 영향이 다르다. 결합력이 강할수록 물질에 운동하는 데 필요한 에너지가 많고, 운동에 필요한 에너지는 분자 간 결합력뿐만 아니라 분자량과 관련이 있다.
[혼성화와 편재 전자모형].줌달 화학
⦁ 혼성화 : 원자궤도함수를 혼성하여 결합에 참여 참여할 수 있는 새로운 궤도함수를 만드는 것
⦁ SP3혼성화 : 메테인 경우 탄소원자에서 한 개의 2S와 세 개의 2p궤도 함수(S1P3) 혼성화하여 네 개의 새로운 궤도함수를 형성하므로 이것을 sp3 hybridization이라 한다. 즉, 탄소원자 sp3혼성화된다.
⦁ 어떤 원자가 정사면체 구조를 가진 원자 궤도함수를 이루는 경우는 언제나 sp3 궤도함수를 만든다. 즉, 그 중심에는 sp3혼성화를 이룬다
⦁ SP2혼성화 : 한 개의 2s와 두 개 2p 궤도함수를 사영하므로 sp2 hybridization이라 한다
⦁ SP혼성화 : 180도를 이루는 두 개의 혼성궤도함수를 얻으려면 한 개의 S궤도함수와 한 개의 p궤도함수가 기여하는 sp혼성화를 하여야 한다. 이 모형에서 한 개의 원자 주위에 두 개의 유효한 전자쌍을 갖는 원자는 항상 sp혼성화를 하여야 한다.
[교재 요약]
⦁ 주기율표에서 주기가 증가하면 원자 전자껍질이 증가하기 때문에 원자의 반지름이 증가하고, 족이 증가하면 원자의 양성자와 전자의 수가 증가하기 때문에 상호인력이 증가하여 전자가 핵쪽으로 가가끼 끌려 존재하여 원자의 반지름이 감소한다. 주기율표에서 왼쪽의 IA, IIA족 우너소들은 오즌쪽의 VIA, VIIA족 원소들보다 전자와 핵 사이의 인력이 약하여 전자가 이탈하기 쉽기 때문에 이온화 에너지가 작은 전자를 가진다. 주기율표에서 오른쪽의 VVIA, VIIA족 원소들은 전자와 핵 간의 인력이 강하여 전자가 첨가되기 쉽기 때문에 전자친화도가 높다. 주기율표에서 왼쪽 하단에 존재하는 원자들은 전기음성도가 작으며, 오른쪽 상단에 존재하는 원자들은 전기음성도가 크다.
⦁ 원자가 화학결합에 의해 상호 결합하는 것은 안정해지려는 경향이 원인이며 이는 자연계에서 매우 안정한 불활성기체와 동일한 전자배치를 하고자 하는 팔전자 규칙(octet rule)으로 설명되는 경우가 많다. 그러나 팔전자 규칙은 화학적 법칙이 아니기 때문에 모든 경우에 맞는 것은 아니다.
⦁ 전자를 내놓기 쉬운 원자(이온화 에너지가 작은 전자를 가진 원자, 전자음성도가 작은 원자, 전자를 잃음으로써 0족 기체와 동이한 전자배치를 하기 쉬운 원자)와 전자를 얻기 쉬운 원자(전자친화도가 큰 원자, 전기음성도가 큰 원자, 전자를 얻음으로써 0족 기체와 동일한 전자배치를 하기 쉬운 원자)가 인접해 있으면 한 원자는 전자를 잃어 양이온으로 전환되고, 한 원자는 전자를 얻어 음이온이 된다. 양이온과 음이온은 정전기적 인력에 의해 이온결합을 형성한다.
⦁ 전지음성도가 동일하거나 유사한 원자간에는 전자를 공유하면서 공유결합을 한다. 두 원자가 전자를 공유하여 전자배치가 0족 기체와 동일하게 됨으로써 안전하게 될 수 있는 팔전자 규칙이 적용되지만, 팔전자 규칙이 모든 경우에 적용되는 것은 아니다. 이 경우 공유되는 전자의 수, 전자가 완전히 공유되지 않고 한 원자로 치우치는 경향 등에 의해 단일결합, 이중결합, 삼중결합, 극성공유결합 등 여러 가지 종류의 공유결합이 존재한다.
⦁ 분자간에는 이온결합과 공유결합외에 반데르발스 힘(쌍극자-쌍극자 힘, 수소결합, 런던분산력, 유발쌍극자 힘)이 있다. 분자 간 화학결합력이 강하면 분자들의 운동에 많은 에너지가 필요하기 때문에 융점‧비점이 높고, 증발열이 크다.
(요약2)
⦁화학결합에 참여하는 원자가전자, 측 최외각전자는 3s²3p²의 전자로서 4개이다. 그러므로 이 원자는 4개의 수소와
전자를 공유하면서 결합을 할 것이다. 3s²3p²의 전자들이 동일한 결합을 하기 위해서는 동일한 궤도함수를 가져야 하므로 3s²의 전자 1개가 p 궤도로 이동하여 전자배치는 3s¹3p³으로 전환된다. 3s¹3p³의 전자들이 모두 동일한
궤도함수를 가지기 위해 혼성되어 3s¹3p³혼성궤도를 형성함으로써 4개의 수소와 동일한 결합을 할 수 있게 된다.
⦁물은 극성분자로서 수소결합을 형성하여 집단을 형성한다. 메탄은 비극성분자로서 런던 분산력에 의해 집단을
형성한다. 수소결합이 런던 분산력보다 훨씬 강하기 때문에 물분자가 개별적으로 운동을 하기 위해서 필요한
에너지가 메탄의 경우보다 크다. 물은 상온, 상압에서는 기체로 전환할 수 있는 충분한 운동에너지를 가질 수 없기 때문에 액체로 존재하고, 메탄은 상온, 상압의 환경이 기체상타로 존재하기에 충분한 운동에너지를 공급할 수 있기 때문에 액체가 아닌 기체 상태로 존재하는 것이다.
⦁ⅠA족 원소들은 분자 반지름이 큰 편이고, 전자친화도가 작으며, 전기음성도가 작기 때문에 전자를 잃고 양이온으로 전환되기 쉽다.
⦁전기음성도는 전자를 당기는 성향의 상대적인 척도이며, 전자친화도와는 동일한 경향이며 이온화 에너지와도 동일한 경향이다. 전기음성도가 큰 원자는 음이온으로, 전기음성도가 작은 원자는 양이온으로 전환되기 쉽다. 원자들이
분자를 형성할 때의 화학결합의 종류 및 분자의 극성과 관련한 특성은 원자들의 전기음성도 및 분자구조의 대칭
여부에 의해 결정된다.
⦁이온결합은 전자의 이탈. 전자에 대한 친화도 등 전자와 관련한 성향이 매우 다른, 즉 전기음성도의 차이가 큰 원자 간에 가능한 결합이다. 그러므로 보유하고 있는 전자의 이온화 에너지가 유사한 원자 간에는 가능하지 않다.
보유하고 있는 전자의 이온화 에너지가 크다는 개념과 원자와 전자친화도가 크다는 개념은 서로 유사한 특성이기
때문에 이러한 원자 간에도 이온결합이 가능하지 않다. 반지름이 차이가 큰 원자 간에는 이온결합이 가능하지만
동일족 원자들에서 주기가 많이 다를 경우 반지름의 차이가 크기 때문에 반지름의 차이가 크다고 해서 이온결합이 형성되는 것은 아니다.
⦁화학결합 중에서 공유결합이 가장 강한 결합력을 갖는다.
⦁분자 간에는 공유결합, 이온결합, 반데르발스 힘에 의한 결합이 모두 가능하다. 극성을 가지지 않는 분자들이라 해도 런던 분산력 유발쌍극자 힘에 의해 약하긴 하지만 극성을 가질 수 있기 때문에 화학결합이 가능하다. 공유결합은
화학결합 중 가장 강력한 결합이다. 수소결합은 쌍극자-쌍극자 힘에 의한 결합의 한 종류이다.
화학결합
원자크기 :
① 주기의 수 증가, 반지름 증가
② 족의 수 증가, 반지름 증가
③ 반지름↓ 음이온전환 쉽고(양이온 전환 어렵고) 이온화 에너지 ↑, 전자친화도↑, 전기음성도↑
이온화 에너지 : 전자를 이탈시키는데 가해야 하는 에너지, 반지름↑ 양이온 전환 쉽고(음이온 전환 어렵고) 이온화 에너지↓, 전자친화도 ↓, 전기음성도↓
원자의 전자친화도 : 원자에 전자가 첨가, 결합될 대 에너지가 방출되는 정도
전기 음성도 : 원자가 전자를 당기는 힘의 척도, 이온화에너지, 전자친화도가 종합된 특성
이온결합 : 전기음성도의 차이가 큰 원자간의 결합
공유결합 : 전기음성도가 동일하거나 유사한 원자간. 8전자규칙
고립전자쌍 : 공유결합에 참여하지 않은 원자가전자쌍. 분자의 모양에 크게 영향
단일결합 : 1쌍의 전자, 시그마결합
이중결합 : 2쌍의 전자, 시그마결합1+파이결합1
삼중결합 : 3쌍의 전자, 시그마결합1+파이결합2
극성공유결합 : 전기음성도가 동일하지 않은 원자간. but, 화학결합이 대칭이면 극성 형성×
삼중결합>이중결합>단일결합
분자의 기하학적 구조 : 원자가전자쌍 반일이론에 근거
분자간 결합 : 이온결합, 공유결합, 반데르발스 힘(쌍극자-쌍극자 힘, 수소결합, 유발쌍극자 힘, 런던분산력)
쌍극자-쌍극자 힘 : 극성공유결합
수소결합 : 쌍극자-쌍극자 힘의 수소를 매개로 한 결합을 특별히 지칭, 반데르발스 힘 중 가장 강함
런던 분산력 : 극성이 없는 분자, 순간적 전자의 쏠림
유발쌍극자 힘 : 극성이 없는 분자, 극성이 있는 분자 접근, 전자의 분내 균형이 깨져...
공유결합>이온결합>수소결합>쌍극자-쌍극자 힘>유발쌍극자 힘·런던 분산력
8. 이온결합 ① 양이온,음이온이 접근하는 경우
② 전기음성도의 차이가 매우 큰 원자들의 결합
9. 공유결합 : 원자들의 전기음성도가 동일하거나 유사하다.
10. 분자간 극성원인: ①쌍극자-쌍극자 힘 ②수소결합 ③런던 분산력 ④유발쌍극자 힘
11. 화학결합들의 세기 : 공유결합>이온결합>수소결합>쌍극자-쌍극자 힘>유발쌍극자 힘·런던분산력>반데르발스 힘
(반데르발스 힘 : 결합력 매우 약함)
12. 1g원자량 = 1g분자량 = 1몰(mole)
▪ mole수가 동일하면 질량의 크기에 관계없이 입자의 숫자 동일
[연습문제]
1.ⅠA족 원소는 양이온, ⅦA족 원소는 음이온이 되기 쉬운 이유를 설명하시오.
☞ⅠA족 원소는 이온화에너지가 대단히 낮은 전자를 가지고 있기 때문에 전자를 잃기 쉬우며, ⅦA족 원소는 전자친화도가 매우 크기 때문에 전자를 받기 쉽다.
2. 전자친화도가 유사한 원자 간에 형성할 수 있는 화학결합과 전자친화도의 차이가 큰 원자 간에 형성될 수 있는 화학결합은 각기 무엇인가?
☞전자친화도가 유사한 원자 간의 화학결합 - 공유결합
전자친화도의 차이가 큰 원자 간의 화학결합 - 이온결합
3. 원자 간에 존재할 수 있는 화학결합과 분자 간에 존재할 수 있는 화학결합의 종류를 제시하고 화학결합들의 세기를 비교하시오.
☞원자 간에 존재하는 화학결합 - 공유결합, 이온결합
분자 간에 존재하는 화학결합 - 공유결합, 이온결합, 반데르발스 힘
4. 다음 중 결합력이 가장 강한 화학결합은 무엇인가?
1] 쌍극자 - 쌍극자 힘 2] 수소결합 3] 이온결합 4] 공유결합
※화학결합의 세기는 공유결합 > 이온결합 > 수소결합 > 쌍극자 - 쌍극자 힘 > 유발 쌍극자 힘·런던 분산력
5. 분자구조를 이론적으로 예측하는 전자쌍 반발이론의 근거는 무엇인가 ?
☞원자의 원자가전자쌍 들은 상호 반발하여 멀리 떨어지고자 한다.
6. 상온상압에서 물은 액체이고, 메탄은 기체인 이유는 무엇인가 ?
☞물은 극성 분자 이고, 메탄은 비극성 분자 이다.
※ 부족하지만 글의 내용이 도움이 조금이라도 되셨다면, 단 1초만 부탁드려도 될까요? 로그인이 필요없는 하트♥(공감) 눌러서 블로그 운영에 힘을 부탁드립니다. 그럼 오늘도 행복한 하루 되십시오^^
'농업생물화학' 카테고리의 다른 글
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 6. 생체물질 (3) | 2022.11.24 |
|---|---|
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 5. 유기화학 (4) | 2022.11.23 |
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 4. 수용액의 화학 (8) | 2022.11.22 |
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 3. 화학반응 (3) | 2022.11.21 |
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 1. 물질의 기본 구성 (5) | 2022.11.20 |