제 1 장 물질의 기본 구성
⦁ 원자(atom) : 자연에 존재하는 물질을 구성하는 최소단위체
⦁ 분자(molecule) : 자연에 존재하는 물질의 단위체
⦁ 이온(ion) : 원자 혹은 분자에 전자가 첨가되거나 전자가 제거된 형태
⦁ 주양자수(principal quantum number) : 원자에 존재하는 전자의 핵으로부터의 거리를 나타내는 양자수
⦁ 각운동량양자수(azimuthal quantum number) : 원자에 존재하는 전자의 운동모양을 나타내는 양자수
⦁ 자기양자수 (magnetic quantum number) : 원자에 존재하는 전자의 운동방향을 나타내는 양자수
⦁ 스핀양자수(magnetic spin quantum number) : 원자에 존재하는 전자의 자전방향을 나타내는 양자수
⦁ 궤도함수(orbital) : 전자가 원자에서 존재하는 양태를 표현하는 함수, 즉 원자에 존재하는 전자의 양자수를 기호로 표현한 식
⦁ 파울리의 배타원리(pauli exclusion principle) : 한 원자 내에 존재하는 전자들이 가진 양자수는 모두 다르다고
하는 원리
⦁ 훈트의 규칙(Hund's law) : 원자 내에 여러 개의 전자가 존재할 때 전자들의 자전방향에 대하여 설명하는 원리이다. 전자들은 동일한 방향으로 자전하는 것이 서로 안정하기 때문에 가급적 동일한 방향으로 회전하는 전자들이 1개씩 각 궤도에 채워진다. 동일방향으로 자전하는 1개씩의 전자가 배치된 후에 나머지 전자들이 각 궤도에 1개씩 더 채워지는데 이들은 반대방향으로 자전한다.
⦁ 원자가전자(valence electrons) : 원자의 최외각궤도에 존재하는 전자로서 화학반응 및 화학결합에 직접 참여한다.
⦁ 주기율표(periodic table) : 원자들을 원자번호와 전자 배치 규칙에 따라 배열한 표
1.1 물질 구성 체계
○물질구성
- 원자(atom) : 원소의 개수, 물질을 이루고 있는 기본입자
- 원소(element) : 종류
- 분자(molecule) : 성질을 띠는 입자, 원자-원자 화학결합, 거대분자, 고분자 유기화합물
- 이온(ion) : 전자의 탈부착, 전기적 특성을 나태는 원자단
1.2 물질 구성 원소
1) 지구 : 무기물 (철, 산소, 실리콘, 마그네슘)
2) 생물체 : 유기물 (탄소, 수소, 산소, 질소)
○식물 : 탄수화물(산소 함량이 높다)
○동물 : 단백질(식물보다 질소함량이 높고 산소 함량이 낮다)

1.3 원자
1.3.1 원자 구성 입자 = 핵 (양성자 + 중성자) + 전자
- 동일종류 원자 : 양성자 숫자 동일 - 원자번호
중성자 숫자 다를 수 있음(동위원소)
- 전자 숫자 : 양성자 숫자와 동일
- 원자량 : 양성자수 + 중성자 수
1.3.2 원자 구성 입자 존재 양태
1.3.2.1 원자모형
(1) 러더퍼드 원자모형
- 양성자와 중성자는 핵으로서 원자 중심부에 존재하며, 전자는 원자 외각에 존재한다
- 원자의 반지름은 100pm인 반면 원자핵의 반지름은 5 X 10-3pm으로서 핵의 부피는 원자부피의 약 1/1013으로 대단히 작다. 그러므로 원자 내부는 거의 텅 빈 공간이나 다름없다.
※ 보어의 수소 원자 모형
보어의 원자 모형은 다음을 가정한다:
• H 원자는 오직 특정한 에너지 준위을 가지고 있고, 보어는 이것을 정류상태라고 불렀다.
– 각 상태는 핵둘레의 전자의 고정된 원궤도와 연관되어있다.
– 높은 에너지 준위을 가질수록 궤도는 핵에서 점점 더 멀어진다.
– H 전자가 첫번째 궤도에 있을때, 원자는 가장 낮은 에너지 상태에 있고, 이것을 바닥상태라고 한다.
• 원자는 하나의 정류상태에 있는 동안 에너지를 내뿜지 않는다.
• 원자는 오직 광자를 흡수하거나 방출함으로서 또다른 정류상태로 바뀐다.
– 광자의 에너지 (hn) 는 두 에너지 상태에서 에너지 간의 차이와 같다.
– 전자가 n=1 보다 높은 어떤 궤도에 있을때, 원자는 들뜬 상태 에있다.
1.3.2.2 원자 내 전자 존재 양태
○빛이 왜 방출되었는가?
→무한히 먼 전자와의 에너지 차이=

, 원자핵으로 부터의 먼거리에 있는 전자의 에너지 준위가 높다 (전자의 에너지양이 크다)
→먼 궤도에 있던 전자가 가까운 궤도로 이동하면서 여분의 에너지가 빛으로 방출된 것이다
○몇가지 종류의 빛만이 방출되었는가?
- 전자가 가지고 있능 수 있는 에너지의 크기는 몇가지로 한정되어 있다(원자에서 전자가 존재할 수 있는 원자핵으로부터의 거리의 종류는 몇가지로 한정되어 있다)
⇒ 전자의 에너지는 양자화(量子化)되어 있다. 양자수값(n)은 양의 정수이다
1.3.2.2.2 현대양자론
→전자의 수가 2개 이상인 원자에서는 보어의 수소이론으로 설명할 수 없는 스펙트럼선들이 나타나 이를 설명하기 위한 새로운 원자모형이 필요하였다. 보어가 제시한 양자수 외에 다른 양자수 개념과 전자와 같은 아주 미립자의 운동양태를 설명해야 했다.
원자에 존재하는 여러 전자들의 존재양태를 설명할 수 있는 양자수(주양자수, 각운동량양자수, 자기양자수), 스핀양자수가 도입됨.
|
주양자수
|
n
|
n의 값은 궤도함수의 상대적 크기를 나타내고 따라서 핵에서의 상대적 거리를 가리킨다.
|
n=1의 궤도(첫번째 껍질)
n=2,3,4인 전자들이 존재궤도
|
|
각운동량양자수
|
|
0부터 (n-1)까지의 정수, 의 값은 궤도함수의 모양을 나타낸다. 전자의 운동모양
|
양자수값(0 ~ n-1)이
0→s / 1→p /2→d / 3→f
|
|
자기양자수
|
|
전자의 운동방향 (-l ~ +l)
– 부터 + 까지의 정수, 의 값은 궤도함수의 공간 방향을 나타낸다.
각 주양수의 껍질별로 존재할 수 있는 전자의 수는
2 x 주양자수2(2n2)개 임
|
각운동량양자수 1인 전자는
자기양자수값이 –1,0,+1(x,y,z축)
|
|
스핀양자수
|
ms
|
자전방향 (왼쪽, 오른쪽) +½ 혹은 -½
|
e_ 스핀의 방향
|
→ 파울리는 “동일한 원자에 존재하는 전자는 어느 것도 4개의 양자수(n l m ms)가 똑같을 수 없다” 배타원리 제안.

1.3.2.2.3 궤도함수

. 전자의 궤도함수 ① 주양자수(n) 1, 각운동량양자수(l) 0 = 1s
② " 3, " 0 = 3s
① (구형) n=1, l=0인 전자궤도 함수는 1s, n=2,l=0인 경우 2s, (l=0인 경우는 자기양자수는 모두 0으로 동일하기에 별도 표현 안함). l=0이므로 방향 동일하고, (s1~s3)핵으로부터 먼거리 전자밀도 형성
② (p궤도)n=2, l=1 자기양자수 표현, l=1인 경우 자기양주수 값(-1,0,+1)(좌표값 x y z)
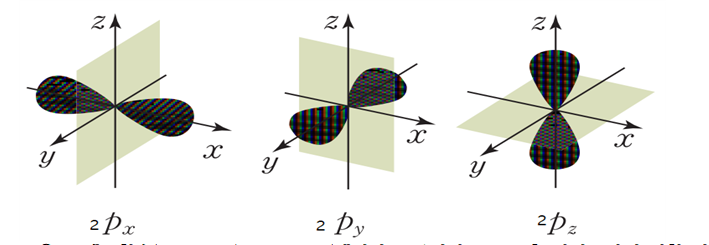
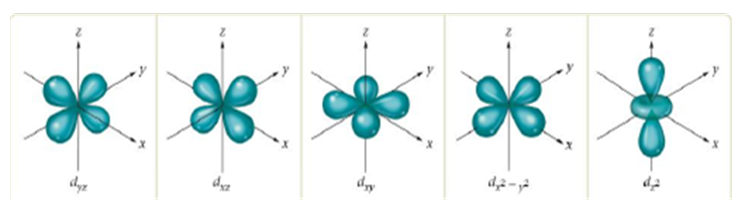
③ d 궤도함수(d orbital) n=3, l=2 (에너지는 동일하 ,x y x축 관련 5가지 방향 나타냄)
1.3.3 원자의 전자 배치
원자에 존재하는 전자들이 어떤 궤도함수를 가지면서 원자에 존재하는가를 연구한 결과 궤도함수의 에너지 준위에 의한 배치, 파울리의 배타원리, 훈트의 규칙 등을 발견하였고, 이 세 원리에 의해 원자에 존재하는 전자들의 궤도함수를 정확하게 알 수 있다. 즉 원자에 여러 개의 전자가 존재할 때 어떤 양태로 존재하는가를 알 수 있다.
① 에너지 준위에 의한 배치
전자의 에너지 준위는 주양자수와 각운동량양자수 값에 의해 결정되며, 에너지가 낮은 준위의 궤도함수로부터 전자들이 배치된다.(전자가 가능한 낮은 에너지를 가짐으로써 안정해지기 때문이다. 에너지 함량이 낮음으로써 안정한 상대 : 바닥상태)
→들뜬 수소의 경우에는 주양자수가 동일한 궤도함수에서는 각운동자양자수가 다르다고 해도 에너지 준위가 모두 동일하다.
→전자가 여러개인 원자에서는 각운동량양자수에 따라 에너지준위가 다를 수 있어 주양자수가 작은 궤도함수가 주양자수가 큰 궤도함수보다 에너지 준위가 클 수 있다. 전자수가 1개인 수소에서부터 18인 Ar까지의 원자들은 전자가 안쪽 궤도로부터 차곡차고 채워지지만 원자본가 19인 K 이후의 원자들은 안쪽 궤도가 비어있는 상태에서 바깥쪽궤도에 전자가 채워진다
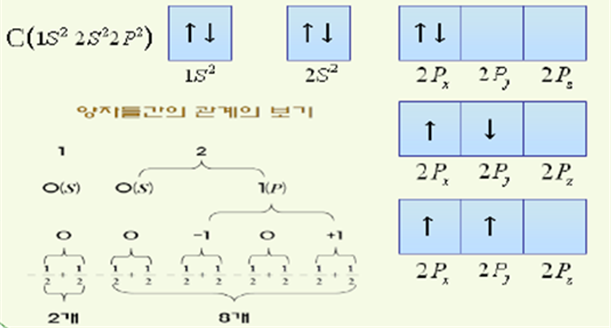

② 파울리의 배타원리
→한 원자내에 존재하는 전자들은 모두 다른 양자수를 갖는다
‘동일한 원자에 존재하는 전자는 어느 것도 4개의 양자수가 똑같을 수 없다’는 원리이다.
③ 훈트의 규칙(Hund’s rule) : 같은 에너지의 궤도함수가 여러 개이면 가장 낮은 에너지를 주는 전자배치는 평행한 스핀을 갖는 홀전자 수를 최대로
→어떤 부준위에서 존자는 가능한 빈 궤도함수에 들어가서 반이 채워진 궤도의 함수가 최대가 되도록 한다. 또 반만 채워진 궤도함수의 전자들은 서로 평행한 스핀을 갖느다. (전자들은 평행한, 동일한 방향의 스핀양자수를 가지는 것이 가장 안정하다)
에너지 준위가 동일한, 즉 주양자수와 각운동량양자수가 동일한 여러 개의 전자들이 어떠한 자기양자수와 스핀양자수의 궤도함수에 배치될 것인가 하는 문제를 설명한다. 이러한 전자들은 평행한, 즉 동일한 방향의 스핀양자수를 가지는 것이 가장 안정하다. 그러므로 우선 다른 자기양자수와 동일한 방향의 스핀양자수를 가지는 전자로 채워진 후에 남는 전자가 있으면 반대방향으로 자전하는 스핀양자수를 가지는 전자가 배치된다.
-쌓음 원리(aufbau principle) : 전자는 항상 가장 낮은 에너지 부준위부터 채워진다.
-배타 원리 : 각 궤도함수는 최대 두 개의 전자를 포함할 수 있고 그 전자들은 반대 방향의 스핀을 가져야 한다.
훈트의 법칙 : 같은 에너지 준위의 궤도함수가 존재할 때, 가장 낮은 에너지는 평행한 홀 전자수가 많은 전자 배열일때 안정하다.
1.3.3.3 원자의 전자배치 표기
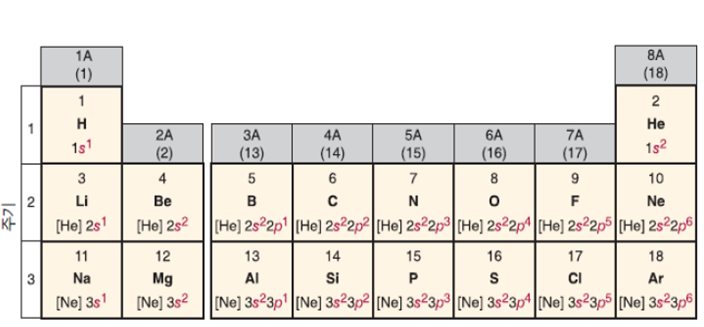
→원자에 존재하는 전자 중에서 화학결합 혹은 화학반응에 직접참여하는 전자는 최외각 궤도의 전자이다. 최외각 궤도의 전자들을 원자가전자(valence electrons)라 한다.

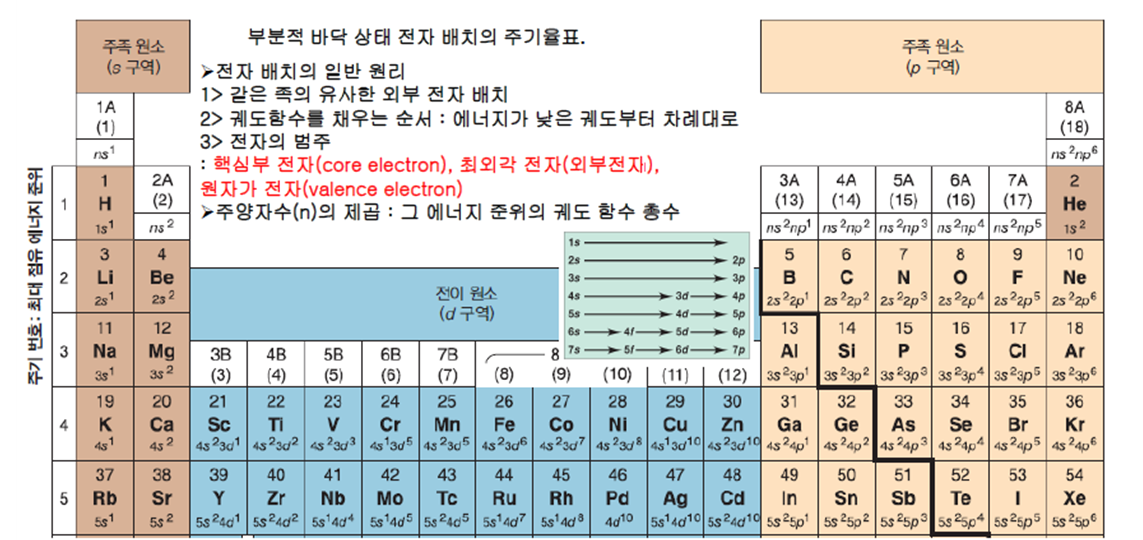
1.3.3.4 주기율표
㉮ 주기율표는 원자들을 양성자 순서에 따라 배열한 표인데 전자 배치의 규칙성과 관련한 정보도 포함되어 있다.
㉯ 원소이름 위의 숫자는 원자번호로서 양성자 수를 의미한다. 전자의 숫자는 양성자 수와 동일하다. 원소이름 밑의 숫자는 원자량이다.
㉰ 동일한 세로줄(족)의 원자(원소)들은 최외각에 존재하는 전자의 숫자가 동일하며 그 숫자는 족의 번호와 동일하다. He은 Ⅷ족 원소이지만 총 전자 수가 2개이기 때문에 최외각에 전자가 2개로서 예외이다.
㉱ 동일한 가로줄(주기)의 원자(원소)들은 전자껍질의 수가 동일하며 그 수는 주기의 수와 동일하다.
㉲ 주기율표에서 동일한 주기에 있는 원자들은 전자껍질의 수는 동일한데 오른쪽에 위치하는 전자일수록(족이 증가할수록) 양성자 수가 많기 때문에 전자를 당기는 힘이 크다.
㉳ 동일한 족에 존재하는 원자들은 밑으로 내려갈수록(주기가 증가할수록) 전자껍질의 수가 많아져 양성자와 전자 간의 거리가 멀어 전자를 당기는 힘이 약화한다.
㉴ Ⅰ A, ⅡA, ⅢA, …… ⅧA족의 원자들은 안쪽 궤도로부터 전자들이 채워져 있고, ⅠB, ⅡB, ⅢB, …… ⅧB족의 원자들은 안쪽 궤도가 채워져 있지 않은 상태에서 외각에 전자가 배치되어 있다. 이는 채워져 있지 않은 안쪽 궤도의 에너지 준위가 외각 궤도의 에너지 준위보다 더 크기 때문이다.
1.4 물질의 자연계 존재 형태
자연계에서 물질은 분자 혹은 이온상태로 존재한다.
1.4.1 분자
자연에 존재하는 전하를 가지지 않는 상태의 모든 물질을 그것이 원자 1개로 구성되어 있거나 원자 여러 개로 구성되어 있거나를 불문하고 모두 분자라 한다. 모든 분자들은 그렇게 존재하는 것이 안정하기 때문이다.
(1) 단원자분자
1개의 원자가 독립적으로 존재하는 분자이며 주기율표상에서 ⅧA족 원소들이 이에 해당한다. 이 원소들을 불활성기체라 한다.
(2) 다원자분자
ⅧA족 원소들을 제외한 원자들은 단독으로 존재하는 것이 안정하지 않기 때문에 다른 원자와 결합하여 다원자분자 형태로 존재한다. 단원자분자 : He, Ne, Ar, Kr 다원자분자 : H2O, CO2
1.4.2 이온
[암기]자연계에서 이온이 형성될 수 있는 환경
㉮ 원자 및 분자는 양성자 수와 전자 수가 동일하기 때문에 전하가 없다. 그러나 전자가 첨가되거나 전자가 이탈할 수 있는 요인이 존재할 때 원자의 전자 숫자가 변화하면서 이온상태로 전환한다.
㉯ 다량의 에너지를 가하거나, 전자를 당기는 힘이 강한 원자 혹은 분자가 인접하여 존재하면 전자가 제거되어 양이온으로 전환될 수 있다.
㉰ 전자를 주고자 하는 성향이 매우 강한 원자 혹은 분자가 인접하여 존재하면 전자를 받아 음이온으로 될 수 있다.
(요약)
물질의 기본 구성
양자 : 어떤 양이 모두 단위량의 정수배로서 나타내어질 때의 단위량. 에너지·전하·각운동량을 비롯한 물리적 성질을 나타내는 불연속적인 최소단위의 물리량.
지구 구성 성분 : 철>산소>실리콘(Si)>마그네슘
식물체 : 산소>탄소>수소>질소, 탄수화물이 주성분
동물체 : 탄소>산소>질소>수소, 단백질이 주성분
양성자 : 1.67×10-24g, 양전하
중성자 : 1.67×10-24g, 전하 없음
전자 : 양성자의 1/1840, 음전하
보어의 수소원자 모형
. 빛 방출 이유 : 원자핵으로부터 멀리 궤도에 있던 전자가 가까운 궤도로 이동하면 여분의 에너지가 빛으로
. 몇 종류의 빛 : 전자의 에너지는 양자화 되어 있다.
- 현대 양지이론
. 주양자수(n) : 보어의 양자수, 원자핵으로부터 거리→에너지를 규정
. 각운동량양자수(l) : 전자의 운동모양, s, p, d, f
. 자기양자수(m) : 전자의 운동방향
. 스핀양자수(ms) : 자전방향
- 파울리의 배타원리 : 동일한 원자에 전재하는 전자는 어느 것도 4개의 양자수가 똑같을 수 없다.
- 궤도함수 : 전자의 주양자수, 각운동양자수, 자기양자수
. n=1, l=0 → 1s
. n=2, l=0 → 2s
. n=3, l=0 → 3s
. n=1, l=2 → 2px, 2py, 2pz,
전자의 수가 많은 원자 중에서(K이후의 원자들) 안쪽 궤도가 비어 있는 상태에서 바깥쪽 궤도에 전자가 채워지는 원자가 있는 이유 : 에너지 준위(주양자수가 작은 궤도함수가 주양자수가 큰 궤도함수 보다 에너지 준위가 클 수 있음)
훈트의 규칙 : 스핀양자수와 관련한 전자의 배치
I A족 : +1로 하전 되기 쉽다(전자 친화도가 작다. 전기 음성도가 낮다), 알칼리금속
II A족 : +2로 하전 되기 쉽다. 알칼리토금속
VII A족 : -1로 하전 되기 쉽다(전자 친화도가 크다. 전기 음성도가 크다). 할로겐원소
VIII A족 : 0족기체 또는 불활성기체, 전자 친화도가 양수,
I B, II B, III B....VIII B : 전이원소(다 채워지지 않은 안쪽 껍질)
|
지구
|
무기물
|
|
철,산소,실리콘,마그네슘 등
|
|
동물
|
단백질 주성분
|
질소함량 높음
|
유기화합물(C,H,O,N 등)
|
|
식물
|
탄수화물 구성
|
산소함량 높음
|
"
|
1. 물질 구성원소
2. 러더퍼드 : 양성자,중성자 → 핵으로서 원자의 중심부에 존재
전자는→ 원자의 외각 부위에 존재
3. “전자의 에너지는 양자화 되어있다” (보어)
|
주양자수
|
보어의 양자수에 해당.원자핵으로부터의 거리 나타냄.
|
|
|
각운동량양자수
|
전자의 운동모양
|
양자수값이
0→s / 1→p /2→d / 3→f
|
|
자기양자수
|
전자의 운동방향
|
|
|
스핀양자수
|
자전방향
|
|
: 원자핵에서 전자가 가지고 있을 수 있는 에너지의 크기는 그 종류가 많지않고 몇가지로 한정되있다.
4. 현대양자수 4가지
5. 전자의 궤도함수 ① 주양자수(n) 1, 각운동량양자수(l) 0 = 1s
② " 3, " 0 = 3s
6. IA(1개), IIA(2개), ⅢA(3개) →최외각의 전자껍질에 전자 존재
① IA족 : 전자가 쉽게 제거되고, (전기음성도 작다)
② VIIA족 : 전자친화도의 음수값이 대단히 크다.
③ VIIIA족 : 전자를 잃는 것이 거의 불가능하다.
7. 이온화에너지 : 안정한 바닥상태의 원자에서 1개의 전자를 제거하는 데 가해야 할 에너지
▪제거되는데 필요한 에너지가 적은 전자(쉽게 이탈)→ 이러한 전자를 가지는 원자는 양이온으로 전환되기 쉽다.
(정리)
제 1장 물질의 기본 구성
⦁핵으로부터 먼 거리의 에너지 준위가 높은 위치에 존재하다가 에너지 준위가 낮은 가까운 거리의 위치로 이동할 때 에너지 함량이 낮아지면서 여분의 에너지가 빛으로 방출된다.
⦁현대양자수가 원자에서 전자가 존재하는 양태를 구체적으로 표현할 수 있는 방법은 제시했으나 한 원자가 존재하는 전자들이 가지는 양자수에 대한 규칙은 제시하지 못하였다. 파울리가 한 원자에 존재하는 전자들 중에서 네 가지
양자수가 동일한 전자는 1개도 없다는 배타원리를 제시함으로써 원자가 존재하는 전자들의 양자수를 정확하게 알 수 있게 되었다. 즉 에너지 준위가 낮은 궤도함수부터 전자가 채워지고, 전자들은 모두 다른 양자수를 가진다는 사실에 근거하여 개별 전자들의 양자수를 확정할 수 있게 되었다.
⦁전자는 원자에서 끊임없이 운동하면서 원자 내부의 모든 공간을 돌아다닌다. 그러므로 원자에서 전자가 존재하는
장소는 한 지점이 아니고 전자의 운동궤적으로 나타난다. 그러나 전자가 존재하는 확률은 장소마다 다르기 때문에 수많은 궤적을 그리면 옅고, 짙은 부위가 마치 구름 형태의 확률밀도로 나타나게 되는 것이다.
⦁원자는 자연계에서 안정한 상태로 존재하고자 하는 경향으로 인하여 불활성기체를 제외한 원자들은 다른 원자와
결합하여 다원자분자의 형태로 존재한다. 이러한 경향은 원자의 전자구성이 직접적인 원인이다.
⦁원자의 질량은 양성자와 중성자에 의해 결정되고 양성자와 중성자의 질량은 다소 차이가 있기는 하지만 동일하다고 해도 무방하다. 양성자와 중성자의 수를 합한 값은 Ar은 40개이고, C는 12개이다. 그러므로 Ar과 C의 질량비율은 40:12=10:3이다.
⦁식물과 동물체의 구성성분은 모두 유기물이지만 식물은 탄수화물이 주요 구성성분이고 동물은 단백질이 주요
구성성분이다. 탄수화물은 탄소와 산소가 각기 40% 이상으로서 질량의 대부분을 차지하고, 단백질은 탄소가 50%
이상을 차지하고 있어 주성분이고, 산소, 질소, 수소가 그 다음으로 10% 내외씩 구성되어 있다.
⦁“전자의 에너지는 양자화되어 있다”는 원자에 존재하는 전자가 가질 수 있는 에너지 크기의 종류는 무한히 많은
것이 아니고 몇 가지로 제한되어 있음을 의미한다. 전자의 에너지는 핵으로부터의 거리와 밀접한 관계를 가지기
때문에 “전자의 에너지는 양자화되어 있다”는 “원자에서 전자가 존재할 수 있는 원자핵으로부터의 거리는 몇 가지로 한정되어 있다”라는 것과 동일한 의미를 가진다.
⦁현대양자수중 전자의 운동모양을 알 수 있는 양자수는 각운동량양자수이다.
⦁전자의 에너지는 주양자수와 각운동량양자수에 의해 결정되는데 주양자수가 더 커 핵으로부터 더 멀리 존재한다
해도 각운동량양자수에 따라 주양자수가 적은 전자(핵으로부터 더 가까이 존재하는 전자)보다 에너지가 더 작을 수 있다. 그러므로 안쪽 궤도에 전자가 다 채워지지 않은 상태에서 바깥 궤도에 전자가 채워지게 된다.
[인강연습문제]
보어가 수소모형에서 제시한 두 가지 중요한 사실을 제시하시오.
☞① 전자의 에너지는 원자핵으로부터 먼 거리에 존재 할수록 에너지 준위가 높다.
② 전자가 원자에 존재 하면서 가질 수 있는 에너지 함량의 종류는 몇 가지로 한정되어 있다. 즉, 원자에서 전자가 존재할 수 있는 원자핵으로부터의 거리는 몇 가지로 한정되어 있다.
2.현대양자수 네 가지를 제시하고 그 의미를 설명하시오.
☞주양자수 - 원자핵으로 부터의 거리 각운동량양자수 - 운동 모양
자기양자수 - 운동 방향 스핀양자수 - 자전 방향
3. n = 3. l = 0 인 전자의 궤도함수는? ☞ 3s
4. 원자에 존재하는 전자의 공간배위가 특정한 장소에 국한하지 않고 구름형태의 확률밀도 그림으로 표현하는 이유는 무엇인가 ?
☞전자는 머물러 있지 않고 끊임없이 움직이고 있기 때문임
5.ⅠA족 원소들의 전자배치의 공통점은 무엇인가?
☞최외각에 전자가 한개 배치되어 있다.
6. 원자의 구조에 대한 설명 중 틀린 것은?
1] 원자는 원자핵과 그 주위를 도는 전자로 구성된다. 2] 원자핵은 양성자와 중성자로 결합되어 있다. 3] 양성자는 (+) 전기를 띤다. 4] 중성자는 (–) 전기를 띤다.☞중성자는 전기를 띠지 않고 전자가 (–) 전기를 띠고 있다.
Q1 원자의 구조에 대한 설명 중 틀린 것은?
1.원자는 원자핵과 그 주위를 도는 전자로 구성된다. 2.원자핵은 양성자와 중성자로 결합되어 있다.
3.양성자는 +전기를 띤다. 4.중성자는 ?전기를 띤다.
Q2. 보어가 수소모형에서 제시한 두 가지 중요한 사실을 제시하시오.
Q3. 현대양자수 네 가지를 제시하고 그 의미를 설명하시오.
Q4. 원자에 존재하는 전자의 공간배위가 특정한 장소에 국한하지 않고 구름형태의 확률밀도 그림으로 표현하는 이유는 무엇인가 ?
※ 부족하지만 글의 내용이 도움이 조금이라도 되셨다면, 단 1초만 부탁드려도 될까요? 로그인이 필요없는 하트♥(공감) 눌러서 블로그 운영에 힘을 부탁드립니다. 그럼 오늘도 행복한 하루 되십시오^^
'농업생물화학' 카테고리의 다른 글
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 6. 생체물질 (3) | 2022.11.24 |
|---|---|
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 5. 유기화학 (4) | 2022.11.23 |
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 4. 수용액의 화학 (8) | 2022.11.22 |
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 3. 화학반응 (3) | 2022.11.21 |
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 2. 화학결합 (7) | 2022.11.20 |