6. 생체물질

⦁단당류(monosaccharide) : 탄수화물의 최소단위체
⦁이당류(disaccharide) : 단당류 2개가 결합하여 형성된 탄수화물
⦁올리고당류(oligosaccharide) : 단당류가 몇 개(10개 내외) 결합하여 형성된 탄수화물
⦁다당류(polysaccharide) : 단당류가 수백 개 이상 결합하여 형성된 탄수화물
⦁알도오스(aldose) : 알데히드기를 가지고 있는 단당류
⦁케토오스(ketose) : 케톤기를 가지고 있는 단당류
⦁피셔(Fisher) 투영식 : 분자구조를 평면적으로 그려 제시한 것
⦁하워드(Haworth) 투영식 : 분자구조를 입체적으로 그려 제시한 것
⦁대장체(enantiomer) : 상호 대칭관계에 있는 입체 이성질체
⦁에피머(epimer) : 부제탄소 1개에 결합되어 있는 원자 및 원자단의 위치가 다른 입체 이성질체
⦁아노머(anomer) : 쇄상구조가 고리구조로 전환할 때 새로이 형성되는 부제탄소의 원자 및 원자단의 배치가 다른 입체 이성질체
⦁녹말(starch) : 식물에서 glucose가 α-1,4 glycoside결합 및 α-1,6 glycoside결합으로 형성된 다당류
⦁글리코겐(glycogen) : 동물에서 glucose가 α-1,4 glycoside결합 및 α-1,6 glycoside결합으로 형성된 다당류
⦁섬유소(cellulose) : glucose가 β-1,4 glycoside결합으로 형성된 다당류
⦁펩티드결합(peptide bond) : 아미노산들의 카르복시기와 아미노기 간에 축합반응에 의해 형성된 결합
⦁등전점(isoelectric point) : 분자 내부의 양전하가 음전하가 동일해지는 pH
⦁α-나선(α-helix) : polypeptide가 나선형으로 꼬인 2차구조
⦁β-형(β-conformation) : polypeptide가 지그재그의 평판모양으로 형성되어 있는 2차구조
⦁β-turn : polypeptide의 방향이 180° 바뀐 구조
⦁1차구조(primary structure) : 단백질의 아미노산 결합 순서
⦁2차구조(secondary structure) : α-나선, β-형, β-turn의 구조를 일컫는다
⦁3차구조(tretiary structure) : 폴리펩티드가 3차원으로 접혀 형성된 구조
⦁4차구조(quaternary structure) : 3차구조 단위체 2개 이상이 결합한 구조
⦁섬유상 단백질(fibrous protein) : polypeptide가 섬유의 모양처럼 2차구조, 즉 α-나선(α-helix),
β-형(β-conformation), β-turn의 구조만으로 형성되어 있는 단백질을 의미한다.
⦁구상단백질(globular protein) : polypeptide가 3차원으로 접혀 형성된 단백질로서 3차구조, 4차구조 단백질이 이에 해당한다.
⦁모티프(motif) : 단백질의 3차구조 내부에서 2차구조가 집단적으로 안정하게 존재하는 부위
⦁도메인(domain) : 구상단백질의 일부가 독립적인 3차구조를 형성하고 있는 부분
⦁로브(lobe) : 도메인과 동일한 의미의 용어
⦁분자 샤페론(molecular chaperone) : 세포에서 polypeptide가 올바르게 접혀 3차 구조를 할 수 있도록 도와주는 단백질
⦁변성(denaturation) : 3차구조가 변화하여 특성이 변화하는 현상
⦁지방산(fatty acid) : 지질을 구성하는 카르복시산
⦁중성지방(fat) : 글리세롤과 지방산이 에스테르결합에 의해 구성된 지질의 일종
⦁포화지방(saturated fat) : 글리세롤과 포화지방산으로 구성된 중성지방
⦁불포화지방(unsaturated fat) : 구성 지방산 중에 불포화지방산이 포함되어 있는 중성지방
⦁극성지질(polar lipid) : 극성을 가지는 지질
⦁인지질(phospholipid) : 글리세롤, 지방산, 인산, 제2알토올로 구성된 극성지질
⦁스핑고지질(sphingolipid) : 스핑고신, 지방산, 극성물질로 구성된 극성지질
⦁왁스(wax) : 분자량이 큰 지방산과 분자량이 큰 알코올이 에스테르결합으로 구성된 지질
⦁스테로이드(steroid) : perhydrocyclopentanopenanthrene을 기본 구조로 하는 지질
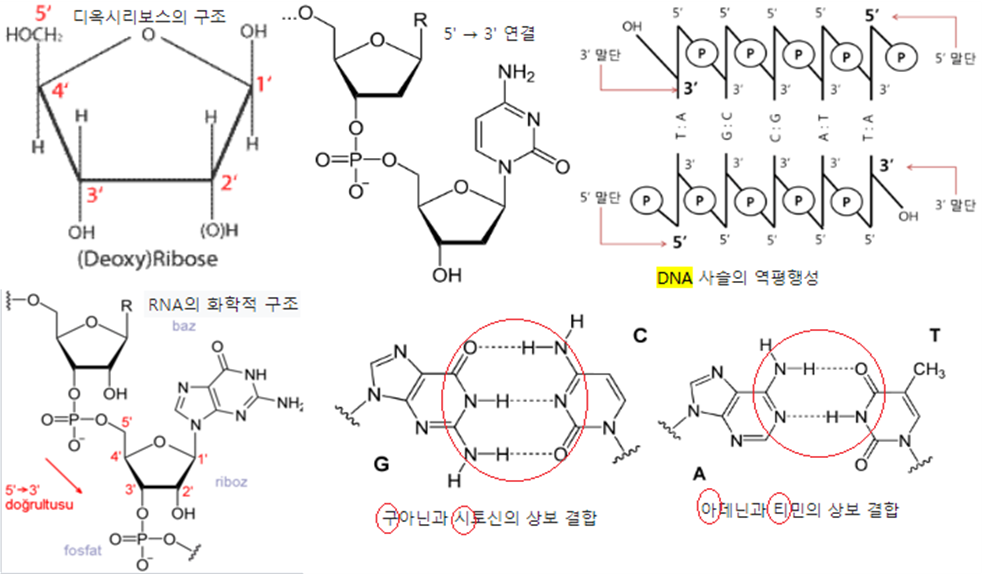
⦁디옥시리보뉴클레오티드(deoxyribonucleotide) : deoxyribose, 염기, 인산으로 구성된 것으로서 DNA의 단위 구성분이다.
⦁리보뉴클레오티드(ribonucleotide) : ribose, 염기, 인산으로 구성된 것으로서 RNA의 단위 구성분이다.
⦁DNA : deoxyribonucleotide 여러 개로 구성된 polydeoxyribonucleotide 2개로 구성된 것으로서 유전정보 보존체
⦁RNA : ribonucleotide 여러 개로 구성된 polyribonucleotide로서 DNA의 유전정보를 발현하는 기능을 가진다.
⦁유전정보(genetic information) : DNA에 보존된 단백질과 RNA의 정보
⦁염색체(chromosome) : 핵에 존재하는 개별 유전정보 물질. 원핵생물의 염색체는 DNA로만 구성되어 있으며 진핵세포 염색체는 DNA와 단백질로 구성되어 있다.
⦁게놈(genome) : 세포에 존재하는 유전정보물질의 총합
⦁상보적 염기(complementary base) : DNA와 RNA를 구성하는 염기로서 상호 결합할 수 있는 염기짝
⦁mRNA : DNA의 유전정보가 전사된 RNA
⦁rRNA : 리보솜을 구성하는 RNA
⦁tRNA : mRNA에 전사된 정보에 따라 해당 아미노산을 운반하여 결하비키는 RNA
⦁코돈(codone) : 단백질 중 1개의 아미노산 정보에 해당하는 mRNA상의 3개의 ribonucleotide
⦁안티코돈(anticodon) : tRNA가 아미노산을 mRNA로 운반한 후 mRNA의 코돈과 결합할 수 있는 상보적 염기의 ribonucleotide로 구성된 부분
⦁수용성 비타민 : 물에 용해하는 비타민으로서 비타민 B복합체, 비타민 C
⦁지용성 비타민 : 물에 용해하지 않는 비타민으로서 비타민A, D, E, K
⦁이소프렌 단위 (isoprene unit) : 지용성 비타민을 구성하는 단위체
6.1. 탄수화물
○ 단당류(monosaccharide)
- 탄소수 : 3탄당(triose), 4탄당(tetrose), 5탄당(pentose),6탄당(hexose)
- 작용기 : 알도오스, 케토오스
○ 소당류(oligosaccharide)
○ 다당류(polysaccharide)
1) 탄수화물의 분류
단당류가 분해되면 탄수화물이 아니기 때문에 단당류를 탄수화물의 기본단위로 구분한다. 탄수화물의 최소단위체인 단당류의 숫자에 근거하여 단당류, 소당류, 다당류로 분류한다. 올리고당류는 단당류가 소량 결합되는 탄수화물이다. 과당, 설탕, 유당 등은 2개의 단당류로 구성된 이당류로 소당류이고, 다당류는 단당류가 수십~수만개 결합되는 탄수화물로 녹말(starch), 글리코덴, 섬유소 등이다.
2) 단당류
(1) 단당류의 분류 : 글루코오스, 갈라토으스, 프룩토오스
㉮ 탄소숫자에 따라 3탄당(triose), 4탄당(tetrose), 5탄당(pentose), 6탄당(hexose) 등으로 분류한다. 3탄당이 가장 작은 단당류이다.
㉯ 작용기에 따라 알데히드기를 가지는 알도오스(aldose), 케톤기를 가지는 케토오스(ketose)로 분류한다.
→aldose : glucose(포도당), galactose →ketose : fructose(설탕)
㉰ 탄소 수, 작용기를 동시에 고려하여 aldotriose, aldotetrose, ketotriose,ketotetrose 등으로 분류하기도 한다.

(2) 단당류 분자구조 표기
쇄상구조는 피셔(Fisher) 투영식으로 표기하며, 고리구조는 일반적으로 하워드(Haworth) 투영식, boat형, chair형 등으로 표시한다. 쇄상구조의 피셔 투영식, 고리구조의 하워드 투영식이 정확한 방법은 아니나 이들 두 가지가 주로 이용된다.
① 피셔 투영식
원자 및 원자단 간의 화학결합을 평면적인 선으로 표시한다. 탄소 간 결합각도가 109.5。이기 때문에 실제 결합 양태는 평면적일 수 없으므로 수평선상에 표시된 결합은 지면 앞으로, 수직선상의 결합은 지면 뒤쪽으로 향하는 것으로 정하였다.
② 하워드 투영식
탄소가 5개 이상이면 쇄상구조와 고리구조가 모두 가능하다. 고리구조를 피셔투영식으로 표기할 수도 있으나 그 형태를 좀 더 정확하게 표기하기 위해 하워드 투영식이 사용된다.
③ 탄소 간의 결합각이 109.5。이기 때문에 뒤틀린 고리구조를 하는데 하워드투영식은 이러한 모양을 나타내지 못하기 때문에 적정한 모형은 아니다. glucose의 경우 boat형과 chair형의 형태가 가능한데 히드록시기들 간의 반 발 때문에 chair형이 안정한 형태이다.
(3) 단당류 이성질체 : 에피머(epimer), 대장체(enantiomer: D-형, L-형), 아노머(anomer, α/β형)
① 대장체(D/L형)
피셔 투영식에서 aldehyde기 혹은 ketone기에서 가장 멀리 있는 부제탄소의 hydroxy기가 오른쪽에 결합되어 있으면 D-형, 왼쪽에 결합되어 있으면 L-형이다. 자연계의 단당류는 대부분 D-형이다.
② anomer(α/β형)
α/β형은 고리구조에서 형성되는 이성질체이다. 쇄상구조가 고리구조로 전환할 때 새로이 형성되는 부제탄소(anomeric carbon)의 hydroxy기가 고리구조 형성에 참여한 히드록시기의 위치가 쇄상구조일 때와 동일한 방향이면 α형, 반대방향이면 β형이다.
단당류가 이당류, 다당류를 구성할 때 anomeric carbon이 결합에 참여할 때 α/β형은 이당류, 다당류의 특성에 미치는 영향이 대단히 크다.※ 다당류 녹말 α-1,4,6-glycoside결합, 섬유소 : β-1,4-glycoside결합.(전분과 섬유소는 구성 단당류 간 화합결합 차이)
(4) 단당류의 화학적 특성
① 환원
aldose가 쇄상구조로 존재할 때 aldehyde기가 산화된다. 자신은 산화되면서 다른 물질을 환원시키기 때문에 환원당이라 한다. ketose의 ketone기는 잘 산화하지 않으나 용액에서 tautomerization에 의해 일부 ketone기가 aldehyde기로 전환하기 때문에 ketose도 환원당이다. 단당류 6개 이상으로 구성된 올리고당과 다당류는 대부분의 aldehyd기 혹은 ketone기가 화학결합에 참여하기 때문에 환원성이 관찰되지 않는다.
② glycoside 형성
탄수화물이 알코올과 반응하면 에스테르(ester)가 형성되는데 이를 glycoside라한다. 이는 단당류끼리 결합하여 이당류, 소당류, 다당류가 형성되는 반응이다.
(5) 주요 단당류
㉮ aldose로서 가장 작은 것은 3탄당인 glyceraldehyde이며, ketose로서 가장 작은 것은 3탄당인 dihydroxyacetone이다.
㉯ 자연계에서 가장 풍부한 것은 aldohexose인 glucose이다.
㉰ aldopentose인 deoxyribose와 ribose는 각기 DNA, RNA의 구성성분이다.
㉱ galactose는 glucose와 함께 lactose(유당)를 구성하며, fructose는 glucose와 함께 sucrose(설탕)를 구성한다.
3) 소당류
소당류 중에서 이당류가 중요하다. 에너지를 저장하는 다당류는 녹말(starch), glycogen이다.
(1) maltose
α-D-glucopyranose의 1번탄소와 D-glucopyranose의 4번탄소가 결합하여 형성된 이당류이다. glucose의 anomer가 α-형이면 α-maltose, β-형이면 β-maltose이다. 녹말이 분해되면 생산된다.
(2) 유당(lactose)
β-D-galactopyranose의 1번탄소와 D-glucopyranose의 4번탄소가 결합하여 형성된 이당류이다. glucose의 anomer가 α-형이면 α-lactose, β-형이면 β-lactose이다. 유당은 포유동물 젖의 주 탄수화물이다. 소장에서 유당분해효소(lactase)가 적게 분비되면 우유를 많이 마셨을 때 유당소장장애(lactose intolerance)현상이 일어난다.
(3) cellobiose
β-D-glucopyranose의 1번탄소와 D-glucopyranose의 4번탄소가 결합하여 형성된 이당류이다. 4번탄소가 결합에 참여한 glucose의 anomer가 α-형이면 αcellobiose, β-형이면 β-cellobiose이다.
(4) 설탕(sucrose)
α-D-glucopyranose의 1번탄소와 β-D-fructofuranose의 2번탄소가 결합하여 형성된 이당류이다. 설탕은 glucose의 aldehyde기와 fructose의 ketone기가 결합에 참여하고 있기 때문에 환원성이 없다.
4) 다당류
(1) 저장 다당류
① 녹말(starch)
㉮ 식물의 에너지가 저장된 저장 다당류이며, 전분이라고도 한다. 녹말은 분자량이 수천∼50만으로서 α-D-glucopyranose 수십 개∼수천 개가 결합되어 있는데 이들이 결합되어 있는 양태에 따라 amylose와 amylopectin으로 분류한다.
㉯ amylose는 α-D-glucopyranose들이 1번 탄소와 4번 탄소 간에 결합하여 구성되는데 이 결합을 α-1,4-glycoside결합이라 한다. amylopectin은 amylose 골격의 24∼30개 glucose마다 α-D-glucopyranose 1번 탄소에 다른 α-D-glucopyranose의 6번 탄소가 결합하여 가지를 친 것이다. 녹말에는 amylose와 amylopectin이 함께 존재한다.
㉰ 녹말은 glucose 간의 α-1,4-glycoside결합의 입체적 배향 때문에 코일구조를 하면서 과립형태를 하고 있으며 친수성 부분인 hydroxy기가 구조 외부에 존재하기 때문에 물과 어울려 물에 현탁된다.
㉱ 녹말은 분자량이 대단히 큰데 식물은 에너지원인 glucose를 분자량이 대단히 큰 녹말의 형태로 저장함으로써 세포의 삼투압이 증가하는 염려 없이 에너지를 저장할 수 있다. 단위동물(사람, 닭, 돼지, 개 등)은 녹말을 분해하는 소화효소(amylase, maltase)를 분비하기 때문에 녹말을 영양소로 이용할수 있다.
② 글리코겐(glycogen)
동물의 에너지 저장물질인 글리코겐은 분자구조와 특성이 녹말과 유사하다. amylose구조의 8∼12개 glucose마다 α-1,6-glycoside결합의 곁가지가 존재하고 분자량은 수백만이다.→세포의 삼투압이 증가하는 염려없이 에너지를 저장할 수 있다. 세포의 낮은 몰랄농도를 유지할 수 있다.
(2) 구조 다당류
① 섬유소
㉮ 섬유소는 β-D-glucopyranose 1만∼1만 5,000개가 β-1,4-glycoside결합에 의해 결합되어 있는데 결합의 입체배향이 일직선이기 때문에 쇄상구조를 하고 있다. 인접한 섬유사 간에는 수소결합을 하면서 차곡차곡 쌓여 견고한 구조를 하고 있다. 섬유소의 hydroxy기들은 구조 내부에 존재하기 때문에 섬유소는 물과 어울리지 않아 현탁되지 않는다. 단위동물(사람, 닭, 돼지)이 섬유소를 영양소로 이용할 수 없는 것은 섬유소를 구성하는 glucose간의 화학결합 때문이다.
㉯ 섬유소는 견고하고 물과 어울리지 않기 때문에 식물체 세포와 조직의 골격을 형성하면서 식물체를 보호하는 기능을 가진다. 그러므로 섬유소는 구조 다당류의 일종이다.
㉰ 반추동물(소, 양)은 섬유소를 분해하는 효소(cellulase)를 분비하면서 이용할 수 있는 세균이 반추위에 서식하기 때문에 섬유소를 영양소로 이용할 수 있다.
② 키틴
키틴(chitin)은 N-acetyl-D-glucosamine이 β(1→ 4) 결합에 의해 결합된 중합체로서 새우, 게, 곤충 등 절지동물의 단단한 껍질인 외부구조를 구성한다.
③ 펩티도글리칸
미생물의 세포벽을 구성하는 다당류인데, N-아세틸글루코사민(N-acetylglucosamine)과 N-아세틸뮤람산(N-acetylmuramic acid)이 β-1,4결합으로 번갈아 가면서 연결되어 있어 견고한 구조를 형성한다.

6.2. 단백질
1) 아미노산
(1) 아미노산 구조
모든 아미노산은 α-탄소에 아미노기(α-아미노기)와 카르복시기(α-카르복시기)가 결합되어 있으며, R이 아노산마다 다르다. 단백질에서 α-아미노기와 α-카르복시기는 펩티드결합에 참여하기 때문에 R 부위가 단백질의 특성에 영향을 미친다.


(2) 아미노산의 분류
pH 7.0의 물에서 R 부위의 상태에 따라 분류한다.
① 비극성 아미노산
•글리신: 수소
•알라닌, 발린, 프롤린, 류신, 이소류신: 지방족 탄화수소
•트립토판, 페닐알라닌: 방향족 탄화수소
•메티오닌: 황
② 극성 아미노산
•세린, 트레오닌, 티로신: 히드록시기
•시스테인: 티올기
•아스파라긴, 글루타민: 아미드기
③ 염기성 아미노산 :
•리신: 아미노기
•아르기닌: 구아니디노기
•히스티딘: 이미다졸기
→ pH7.0에서 양전하를 띤다. 반응성이 크므로 효소의 활성자리에서 반응에 참여하는 경우가 많다.
④ 산성(음전하) 아미노산
•아스파르트산, 글루탐산: 카르복시기
→aspartic acid와 glutamic acid는 R 부위에 카르복시기가 존재하기 때문에 pH 7.0에서 음이온으로 하전된다. 반응성이 크기 때문에 효소의 활성자리에 존재하는 경우가 많다.
(3) 아미노산의 화학적 특성 : 산, 알칼리에 잘 녹음(에테르, 알코올에는 녹지 않음)
ㅇ 양성 성질(쌍극성 이온: zwitter ion): pH buffer로 이용
- 단백질은 양성과 음성으로 하전
- 용액이 산성: 양전하를 띄고 음극으로 끌림
- 용액이 알카리성: 음전하를 띄고 양극으로 끌림
- 등전점보다 낮은 pH: 양전하
- 등전점보다 높은 pH: 음전하
- 등전점: 어떤 완충액 내에서는 양성의 하전량과 음성의 하전량이 같게 되는데 이 완충액의 pH

① 아미노산의 이온화
아미노산의 작용기들은 pH에 따라 수소이온과 결합하거나 수소이온이 이탈하여 이온화한다. pH가 낮아 환경에 수소이온이 풍부하면 아미노산의 수소이온이 결합할 수 있는 부위에는 수소이온이 모두 결합하여 아미노산은 양전하를 가진다. pH가 상승하면서 환경에 수소이온의 농도가 낮아지면 아미노산에 결합되어 있던 수소이온이 이탈한다. 이에 따라 아미노산의 양전하량이 감소해 가다가 양전하량과 음전하량이 동일한 과정을 거쳐 음전하량이 우세하게 되어 음전하를 띠게 된다. 양전하량과 음전하량이 동일한 pH를 등전점(isolectric point: PI)이라 한다.
② 아미노산 적정곡선
아미노산이 용해되어 있는 산성 수용액에 알칼리를 첨가할 때 pH가 증가하면서 아미노산의 하전상태가 변화하는 양태를 나타내는 곡선을 적정곡선이라 한다. 이 곡선에서 pK와 등전점을 알 수 있다.
㉮ pH가 증가하면서 아미노산으로부터 수소이온이 이탈하기 시작하는데 수소이온이 아직 이탈하지 않은 아미노산과 수소이온이 이탈한 아미노산의 농도가 동일한 pH를 pK라 한다. 수소이온이 결합하거나 이탈하는 작용기가 2개면 pK가 2개이고, 작용기가 3개인 경우는 pK가 3개이다.
㉯ 두 pK 사이의 중간 pH가 등전점이다.
③ R 부위 작용기
R 부위의 작용기 특히 산성 아미노산과 염기성 아미노산 R 부위의 작용기는 탄백질의 생물학적 활성에 기여한다. 작용기가 효소의 활성 부위에 존재하면서 효소활성의 원인이 되는 경우가 많다.
2) 단백질
(1) 단백질 구조
① 1차구조
단백질의 아미노산 순서가 1차구조(primary structure)이다. 단백질을 구성하는 아미노산의 순서는 유리아미노기의 아미노산으로부터 시작하여 유리 carboxyl기로 번호를 부여하여 표시한다.
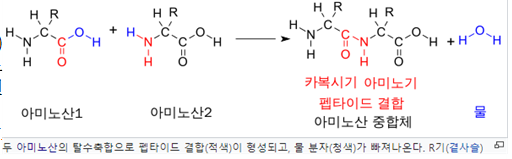
-펩타이드 결합(peptide bond)은 하나의 아미노산의 카복실기의 1번 탄소(C-1)와 펩타이드 또는 단백질 사슬 상의 또 다른 아미노산의 아미노기의 2번 질소(N-2) 간에 탈수축합 반응으로 형성되는 아마이드 형태의 공유 결합이다.
-두 개의 아미노산이 펩타이드 결합을 통해 다이펩타이드를 형성할 때, 이것은 축합 반응의 일종이다. 이런 종류의 축합에서, 두 개의 아미노산 중 하나는 비측쇄 카복실기(C-1) 부분이, 다른 하나는 비측쇄 아미노기(N-2) 부분이 서로 접근하면서 반응이 일어난다. 하나는 카복실기(-COOH)에서 수소와 산소를 잃고, 다른 하나는 아미노기(-NH2)에서 수소를 잃는다. 이러한 반응으로 물(H2O) 분자와 두 개의 아미노산이 펩타이드 결합(-CO-NH-)으로 연결된 화합물이 형성된다. 두 아미노산이 결합된 화합물을 다이펩타이드라고 부른다.
-아마이드 결합은 한 아미노산 분자의 카복실기가 다른 아미노산 분자의 아미노기와 반응하여 물(H2O) 분자를 방출하면서 합성되므로 탈수축합 반응이다.



② 2차구조 : 단백질의 1차구조가 펩타이드결합간의 수소결합으로 인해 나타나는 구조. alpha나선구조와 beta병풍구조가 있다.
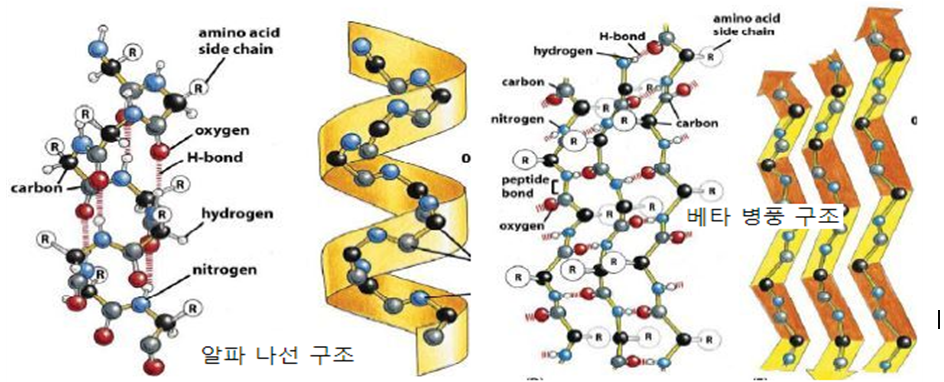
㉮ 단백질의 1차구조는 아미노산 구성에 따라 나선형으로 꼬이거나(α-나선),병풍처럼 판상구조(β-형)를 하거나, 진행방향이 180。 변화(β-turn)할 수 있는데 이들을 2차구조(secondary structure)라 하고, 2차구조만을 가지고 있는 단백질을 섬유상단백질이라 한다.
㉯ α-나선과 β-형의 2차구조에서는 물과 잘 어울리는 친수성 부위(극성 R, 이온성 R 부위)가 대부분 분자 내부에 존재하기 때문에 2차구조만으로 구성된 단백질은 물과 어울리지 않는다. 즉 물에 젖지 않으면서 안정하게 유지될 수 있다. 이는 동물체의 몸을 보호하는 기능의 원인이 된다.
㉰ 나선형의 2차구조는 1차구조가 오른쪽감기 혹은 왼쪽감기 형으로 꼬일 수있는데 자연계 단백질에 존재하는 2차구조는 대부분 오른쪽감기의 형태이다. 머리카락, 양모는 α-나선의 2차구조만으로 형성되어 있는 단백질이다. α-나선 2차구조는 분자 내 수소결합 및 disulfide결합에 의해 안정하게 유지된다.
㉱ 1차구조가 지그재그의 모양을 하는 것을 β-형이라 하는데, 인접하는 다른 1차구조의 β-형이 존재하면 상호 수소결합을 하면서 판상구조를 한다. 이를 β-sheet라 한다. 명주실과 거미줄 단백질인 fibroin이 β-sheet 구조를 가지고 있다.
㉲ 1차구조에서 proline 혹은 glycine이 존재하는 부위는 1차구조의 방향이 바뀌며, 이를 β-turn이라 한다.
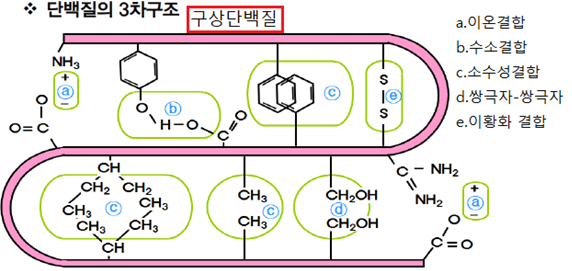
③ 3차구조
㉮ 1차구조의 polypeptide는 3차 공간구조를 가지면서 복잡한 특정 구조를 가지는데 이를 3차구조(tertiary structure)라 하며 3차구조의
단백질을 구상단백질이라 한다. 효소, 호르몬, 물질운반 단백질, 면역 단백질 등 특별한 생물학적 기능을 가지는 단백질은 3차구조를 하고 있다.
㉯ 단백질의 3차구조는 아미노산 결합 순서에 해당하는 1차구조가 원인이지만 세포에서 polypeptide가 생산된 후 3차구조가 형성될 때 샤페론(molecula chaperone)이 올바른 3차구조가 형성되는 것을 도와준다.
㉰ 단백질의 3차구조에는 1차구조만 존재할 수도 있고, 2차구조가 포함되어 있을 수도 있다. 2차구조들이 3차구조에 존재하면서 접혀 안정한 구조를 하고 있는 것을 모티프(motif)라 한다.
㉱ 하나의 구상단백질에 독립된 3차구조가 여러 개 존재하기도 하는데 이들을 각기 도메인(domain) 혹은 로브(lobe)라 한다.
㉲ 단백질의 3차구조를 가능하게 하면서 3차구조를 안정하게 유지되도록 하는 것은 이온결합, 수소결합, 소수성결합, 쌍극자-쌍극자 힘, 이황화 결합(disulfide결합) 등 각종 화학결합이다. 이황화 결합은 공유결합이기 때문에 이 결합을 가지고 있는 3차구조는 매우 안정하다. 소수성 결합은 3차구조 내부에 형성되어 있다.
④ 4차구조
㉮ 단백질 중에는 3차구조 단백질이 2개 이상 함께 결합하면서 존재하는 것도있다. 이를 4차구조(quaternary structure)라 한다. 3차구조 1개로 구성된 것을 monomer, 3차구조 2개로 구성된 것을 dimer, 3개로 구성된 것을 trimer, 여러 개로 구성된 것을 multimer 등으로 표현한다. 각 3차구조 단백질을 단위체(subunit)라 한다.
㉯ 단백질에 따라 4차구조를 형성하고 있어야 기능을 가지는 것이 있고, 개별기능을 유지하는 monomer의 숫자가 증가하면서 기능이 함께 증가하는 경우도 있다.
(2) 단백질 기능
① 섬유상 단백질
보호기능(털, 깃털), 운동기능(myosin, actin)
② 구상단백질
생리적 기능(효소, 호르몬), 방어기능(면역단백질), 운반기능(헤모글로빈)
6.3. 지질
1) 지질의 분류
- 중성지방 : 글리세롤, 지방산
- 인지질 : 글리세롤, 지방산, 인산, 제2알코올
- 스핑고지질 : 시핑고싞(아미노알코올), 지방산, 극성머리부위
- 왁스 : 알코올, 지방산
- 스테로이드 : 콜레스테롤, 스티그마스테롤
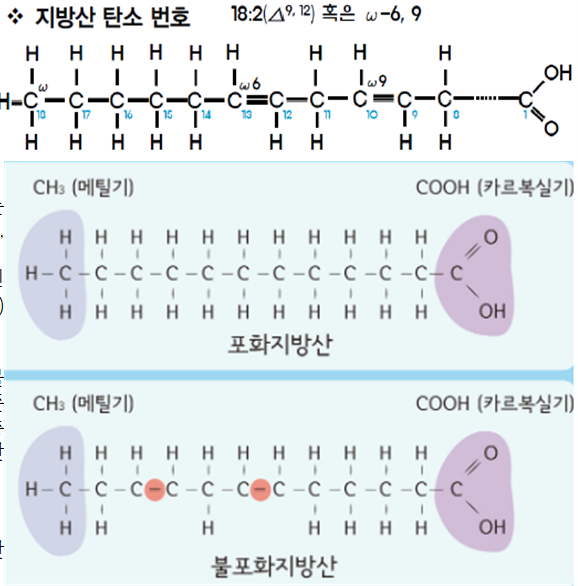
지방산은 탄화수소 사슬의 끝에 카르복시기가 결합되는 구조를 가진다. 지질은 구조와 특성에 따라 중성지방, 극성지질, 스테로이드게 지질, 왁스 등 으로 분류한다.
-지방산의 화학구조는 4~24개의 탄소원자를 갖는 긴 사슬로 양쪽 끝에 카르복실기(-COOH)와 메틸기(-CH3)를 갖는 탄화수소꼬리 형태입니다.
2) 중성지방
지방산과 글리세롤의 ester로서 극성을 가지지 않아 물에 용해하지 않는다. 자연계와 생물체에 제일 많이 존재하는 지질이며 생물체의 에너지 저장물질, 물리적 충격의 완화, 피하에 층을 이루어 체온 유지, 필수지방산의 공급 등의 기능을가진다.
(1) 중성지방의 종류
① 글리세롤에 결합된 지방산 수
•monoacylglycerol(monoglyceride): 1개의 지방산이 결합
•diacylglycerol(diglyceride): 2개의 지방산이 결합
•triacylglycerol(triglyceride): 3개의 지방산이 결합, 자연계에 triacylglycerol이 제일 많다.
② 글리세롤에 결합된 지방산 종류의 동일 여부
•복합지방: 여러 가지 종류의 지방산이 결합. 자연계의 중성지방은 대부분 복합지방이다.
•단순지방: 동일한 종류의 지방산이 결합
③ 지방산의 불포화 여부
•포화지방: 포화지방산으로 구성. 동물성 지방에 많다.
•불포화지방: 불포화지방산이 포함되어 있는 지방. 식물성 지방에 많다.
(2) 지방산
① 융점
㉮ 포화지방산은 지방산 탄소사슬이 탄소 간 결합각도인 109.5。번갈아 가면서 형성되어 트랜스형 구조를 하고 있다. 지방산들이 모여 있을때 지방산 간에 밀착되어 상호 인력이 강하여 융점이 높다.
㉯ 불포화지방산은 불포화결합 부위는 cis의 구조를 하기 때문에 불포화결합 부위에서 꾸부러진다. 그러므로 불포화지방산들이 모여 있으면 성긴 구조를 하여 지방산 간에 인력이 약하여 융점이 낮다.
② 필수지방산
linoleic acid, ç-linolenic acid는 사람, 닭, 돼지가 합성하지 못하는 필수지방산이다.
③ Σ3 다가 불포화지방산
EPA(eicosapentaenoic acid), DHA(docosahexaenoic acid)는 동맥경화, 심장질환,관절염 등을 방지하는 기능을 가지고 있다.
(3) 중성지방
① 융점
㉮ 동물성 지방은 포화지방산 함량이 높기 때문에 융점이 높아 실온에서 고체이다.
㉯ 식물성 지방은 불포화지방산 함량이 높아 융점이 낮기 때문에 실온에서 액상이다.
② 산화
불포화지방산 함량이 높으면 자동산화하여 산패하기 쉽다.
③ 비누화반응
지방에 염기(KOH, NaOH)를 반응시키면 지방산 염인 RCOOK와 RCOONa가 생성되는데 이들이 비누이다.
④ 생물체에서의 기능
㉮ 탄수화물, 단백질보다 덜 산화된 상태이고, 소수성이어서 체내에서 작은 부피로 존재하기 때문에 에너지 저장물질로서 장점이 크다.
㉯ 피부, 복강에 축적되어 있으면서 체온유지 및 충격으로부터 보호한다.
3) 극성지질
- 인지질 : 글리세롤, 지방산 → 비극성
인산, 제2알코올 → 극성
- 스핑고지질 : 스핑고싞, 지방산 → 비극성
극성 머리부위 → 극성
(1) 종류
인지질과 스핑고지질은 분자의 일부가 극성을 가지거나 하전되어 있다.
(2) 기능
세포막의 구성분으로 bilayer로 존재하면서 친수성 부위는 세포 밖의 체액, 그리고 세포 안쪽의 시토졸과 접해 있고, 소수성 부위는 세포막 내부로 향해 있으면서 세포막이 물질들을 선택적으로 통과시키는 기능을 가질 수 있는 환경을 형성한다.
4) 스테로이드계 지질
(1) 종류
스테로이드는 perhydro cyclopentano penan threne의 유도체로서 동물의 스테로이드계 지질은 콜레스테롤, 식물의 스테로이드계 지질은 스티그마스테롤이다.
(2) 특성 및 기능
㉮ 스테로이드계 지질은 유연성이 나쁘기 때문에 콜레스테롤이 동맥에 침적되면 동맥혈관의 유연성이 감소하여 혈관질환의 원인이 된다.
㉯ 스테로이드는 담즙산, 비타민 D, 성호르몬의 합성원료로 사용된다.
5) 왁스
(1) 특성
분자량이 매우 큰(탄소 수 14∼36) 지방산과 분자량이 큰 알코올(16∼30)의 ester이다. 지방산은 불포화지방산일 수도 있으나 지방산과 알코올의 분자량이 매우크기 때문에 융점이 매우 높다. 그러므로 실온에서 고체의 형태로 존재한다.
(2) 기능
비극성이기 때문에 생물체 표면에서 몸이 물에 젖는 것을 방지한다.
6.4. 핵산
- DNA : ploydeoxyribonucleotide - deoxyribose, 염기, 인산
- RNA : polyribonucleotide - ribose, 염기, 인산
1) DNA
㉮ deoxyribose, 염기, 인산이 결합한 deoxyribonucleotide 여러 개가 결합한 polydeoxyribonuceotide 두 가닥으로 구성되어 있다. 염기가 adenine, guanine, cytosine, thymine 네 가지이며, 따라서 deoxyribonucleotide도 네종류가 있다.
㉯ polydeoxyribonucleotide 두 가닥은 반대방향으로 결합해 있으며, 상호 상보적 염기 간의 수소결합에 의해 안정한 구조를 유지한다. adenine-thymine, guanine-cytosine이 상보적 염기의 관계에 있다. 수소결합의 숫자 및 내부공간 크기(DNA구조 유지 이유)
㉰ DNA의 유전정보가 전사되는 경우 DNA에 상보적인 염기의 ribonucleotide가 결합하여 mRNA가 합성된다. DNA의 adenine, thymine, guanine, cytosine 염기들에 대한 RNA의 상보적 염기는 각기 uracil, adenine, cytosine, guanine이다.
- 핵산 상보적염기(complementary base)
- DNA-mRNA : A-U, T-A, G-C -mRNA-tRNA : A-U, G-C
㉱ DNA에 존재하는 유전정보는 네 가지 deoxyribonucleotide들의 순서이다.
㉲ DNA의 크기를 bp(base pair)로 표시하는데, DNA상에서 상호 결합하고 있는 상보적 염기를 가지는 deoxyribonucleotide 한 쌍이 1bp이다.
※deoxyribonucleotide는 DNA의 단량체(또는 단위체)이다. 보통 DNA를 구성하는 뉴클레오타이드가 단독으로 존재하는 형태를 지칭한다. 각각의 deoxyribonucleotide는 질소 염기, deoxyribo(5탄당), 인산의 세 부분으로 구성되어 있다
2) 염색체
㉮ 개별 DNA를 염색체라 하고, 생물체 종(species)마다 세포당 일정한 개수의 염색체가 존재한다. 세포에 존재하는 모든 유전정보 물질을 통틀어 게놈(genome)이라 한다. virus의 게놈은 DNA 혹은 RNA이다.
㉯ DNA는 매우 크기 때문에 작은 부피의 구조를 가지고 있어야 매우 좁은 세포에서 존재할 수 있다. 세균의 염색체는 겹환상구조를 가지며, 꼬이고 접혀 부피가 매우 작게 된 상태에서 존재하는데 이를 supercoiling이라 한다. 진핵세포의 염색체는 겹선형구조를 가지며, DNA 외에 히스톤 단백질, 인 등이 존재하는데 히스톤단백질이 DNA가 감기는 축이 되어 nucleosome을 형성하고 nucleosome이 다시 모여 밀집구조를 형성하여 핵에 존재한다.
㉰ 생물체에서 유전정보가 존재하는 주 기관은 염색체이나, 염색체보다 유전정보량이 매우 작은 DNA가 존재하기도 한다. plasmid는 세균에 존재하는 DNA로서 생명현상에 비필수적인 유전정보가 존재한다. 진핵세포의 미토콘드리아와 엽록체에 소량의 유전자가 존재한다. 미토콘드리아와 엽록체의 DNA는 생물체가 진화하는 과정에서 세균이 진핵세포에 들어온 후 그 DNA가 남아 있는 것으로 추정한다.
ㅇ 핵산-염색체 외 DNA
- plasmid : 세균 염색체의 0.01 ∼5%, 비필수 형질 유전자
- 미토콘드리아, 엽록체 DNA : 염색체의 0.1%, tRNA, rRNA, 단백질 유전정보
3) RNA
ㅇ RNA 종류
- messenger RNA(mRNA) : DNA 유전정보 전사, 단백질 합성 귺거
- ribosomal RNA(rRNA) : 원핵세포 30S+50S →70S, 진핵세포 40S+60S →80S
- transfer RNA(tRNA) : 아미노산 결합부위(3’ 말단),nticodon
㉮ ribose, 염기, 인산으로 구성된 ribonucleotide 여러 개가 결합한 polyribonucleotide한 가닥이다. 염기가 adenine, guanine, cytosine, uracil 네가지 있으며, 따라서 ribonucleotide도 네 종류가 있다
㉯ RNA에는 mRNA, rRNA, tRNA가 있으며, 이들은 DNA의 유전정보가 발현되는 것을 매개한다. mRNA는 DNA의 구조(유전정보)에 근거하여 합성됨으로써 유전정보를 전사한다. rRNA는 리보솜을 구성하여 mRNA에 전사된 유전정보(아미노산 결합 순서)에 따라 해당 아미노산들이 결합하는 반응이 일어나는 장소를 제공한다.
4) tRNA
tRNA는 mRNA에 전사된 유전정보(단백질의 아미노산 결합 순서)에 따라 해당 아미노산을 리보솜에 결합해 있는 mRNA에 운반한다. 해당하는 아미노산을 운반할 수 있는 구조적 근거는 3′ 말단과 anticodon 부위이다.→ mRNA의 코돈과 tRNA의 안티코돈 구조가 전사된 유전정보에 따라 해당 아미노산이 결합하여 폴리펩테드가 형성되도록 하는 근거인 것이다.
※codon : tRNA의 안티코돈 부위가 결합하는 mRNA의 3개의 리보뉴클레오티드 ※안티코돈:mRNA의 RNA사슬을 이루는 특정구간
ㅇ 단백질 형성과정
- 세포에서 이루어지는 단백질의 형성에는 RNA, DNA, 리보솜, 효소 등이 관여한다. 단백질의 형성과정은 다음과 같다
1.DNA에서 mRNA가 전사된다. 동시에 세포 내에서는 아미노산 활성화 효소에 의해 tRNA에 아미노산(amino acid)이 부착된다.
2.mRNA의 뉴클레오타이드는 3개씩 짝을 이뤄 하나의 아미노산을 지정한다. 예를 들어 UUU(우라실-우라실-우라실)는 페닐알라닌을 지정한다.
3.전사된 mRNA가 리보솜의 소단위체(small subunit)에 부착된다.
4.1번에서 아미노산이 부착된 tRNA가 mRNA의 지정된 염기서열의 뉴클레오타이드에 부착된다.
5.리보솜의 큰 단위체(large subunit)가 소단위체(small subunit)와 결합한다.
6.mRNA의 다음 염기서열과 짝을 이루는 tRNA가 리보솜에 들어오고 여기에 부착된 아미노산은 앞의 tRNA에 부착된 아미노산과 결합한다.(오른쪽 그림의 두 번째 단계)
7.mRNA의 염기서열이 끝날 때까지 위 과정이 반복되면 긴 아미노산 사슬이 형성된다. 이것이 단백질이다. 단백질은 효소에 의해 접혀 적절한 모양을 갖추게 된다.(오른쪽 그림의 끝 단계)
8.세포 내에는 수많은 리보솜이 있어 하나의 mRNA를 이용하여 동시에 작업할 수 있다.
6.5. 비타민
1) 지용성 비타민
비타민은 물에 용해하는가 여부에 따라 수용성 비타민과 지용성 비타민으로 구분한다. 지용성 비타민은 비타민 A, D, E, K이며 이들은 isoprene 단위로 구성되어 있어 구조에 공통점이 있다. 비타민 B 복합체, C가 수용성 비타민이며 이들은 구조에 공통점이 없다.
ㅇ 지용성 비타민 : 이소프렌 단위체로 물에 용해되지 않음
- A : cis retinal → trans retinal
- D : Ca 흡수, 골격형성 대사
- E : 전자공급, 산화반응 중단
- K : 혈장 prothrombin의 glutamate → thrombin 형성. 피브린 전환으로 혈액 응고 2) 지용성 비타민
(1) 비타민 A
비타민 A는 망막의 retinal의 구성성분이다. retinal은 광에너지에 의해 구조가 cis형에서 trans형으로 전환하여 시각을 느끼게 한다.
(2) 비타민 D
비타민 D(cholecalciferol)는 간과 신장에서 1,25-dihydrocholecalciferol로 전환되어 칼슘의 흡수에 관여한다.
(3) 비타민 E
비타민 E는 불포화지방산 산화과정에서 형성되는 자유 라디칼에 전자를 공급함으로써 산화반응을 중단시킨다.
(4) 비타민 K
비타민 K는 혈액의 prothrombin의 glutamate 부위를 carboxyglutamate로 전환하여 Ca과 결합할 수 있도록 하여 혈액응고에 기여하는 thrombin이 합성되도록 한다.
2) 수용성 비타민 : 체내에 축적되지 않는다
ㅇ B 복합체
- B1(thiamine) : 알데히드기 전이
- B2(riboflavin) : 산화·환원반응
- 니코틴산 : 전자의 일시적 운반체
- 판토텐산 : coenzyme A 구성성분
- B6 : 아미노기전달 매개체
ㅇ C
- 조효소 : proline → hydroxyproline
- 산화 : 고온에서 산화 촉진
(1) 비타민 B 복합체
비타민 B 복합체에는 여러 가지 비타민들이 포함되어 있는데 이들은 생물체에서 동일한 장소에서 함께 발견되기 때문에 비타민 B 복합체로 명명하였다. 그러나 구조와 특성에서 공통점이 있는 것은 아니다. 이들은 거의 대부분 대사반응에서 효소의 반응을 보조하는 조효소로서의 기능을 가지고 있다.
(2) 비타민 C
비타민 C는 척추동물 결합조직에 중요한 4-hydroxyproline을 합성하는 반응의 조효소로 작용한다. 비타민 C는 산화하면 dehydro-L-ascorbic를 거쳐 diketo-L-gluconic acid로 전환되는데 dehydro-L-ascorbic은 다시 비타민 C로 전환될 수 있으나 diketo-Lgluconic acid는 비타민 C로 되돌아갈 수 없어 비타민 C가 파괴된 것이다. 이러한 산화반응은 온도가 높을수록 빨리 진행되기 때문에 비타민 C는 열에 약하다.
< 연습문제 >
1. 단위동물과 반추동물의 탄수화물 이용 기능이 다른 이유는 무엇인가?
→ 단위동물은 녹말을 분해할 수 있는 α-아밀라아제는 분비하지만 섬유소를 분해하는 셀룰라아제는 분비하지 못하기 때문에 섬유소는 영양소로 이용하지 못한다. 반추동물은 반추위에 존재하는 미생물이 셀룰라아제를 분비하여 섬유소를 분해하기 때문에 섬유소를 영양소로 이용할 수 있다.
2. 우유를 과다하게 마시면 설사를 하는 이유는 무엇인가?
→ 소장에서 우유의 유당을 분해할 수 있는 락타아제가 부족하게 분비되는 것이 원인이다. 분해되지 않은 유당이 대장으로 이행하면 대장의 삼투압이 증가하여 대장 내용물의 수분 함량이 비정상적으로 증가하면 설사를 하게 된다.
3. 시스틴 함량이 매우 높은 구상단백질이 있다. 이 단백질의 안정성을 예측하고 그 이유를 설명하시오.
→ 시스틴 두 분자가 근접하면 이황화 결합을 형성한다. 이황화 결합은 공유결합으로 서 단백질의 3차구조 유지에 가장 강하게 기여하는 화학결합이다. 그러므로 시스틴 함량이 높으면 3차구조에서 서로 접근하는 경우 이황화 결합을 형성할 가능성이 크기 때문에 단백질의 3차구조가 대단히 안정하다.
4. 단백질의 모든 특성과 기능은 근본적으로 무엇으로부터 연유하는가?
→ 단백질의 특성과 기능의 원인은 폴리펩티드상의 아미노산 구성과 순서인데 이는 해당 단백질의 유전자의 유전정보가 근거가 되는 것이다. 그러므로 단백질의 특성과 기능은 유전자의 유전정보가 원인이다.
5. 중성지방이 생물체의 에너지 저장물질로서 적절한 이유는 무엇인가?
→ 중성지방은 탄수화물과 단백질보다 산화가 덜 되어 에너지생산 대사에서 에너지를 더 많이 생산할 뿐만 아니라 소수성이기 때문에 체내에서 가급적 수분과 접촉을 적게 하기 위해 작은 부피를 유지하고자 하므로 적은 용적을 차지한다.
6. 세포막에서 극성지질의 기능은 무엇인가?
→ 극성지질의 친수성 부위가 세포막의 밖과 안쪽으로 향하고 소수성 부위는 세포막의 중심부에 향하여 위치함으로써 세포 밖과 세포 안의 물과 접해 있으면서 세포밖의 체액과 세포 안의 세포액의 물에 용해되어 있는 물질이 세포막으로 접근할 수있도록 한다. 세포막 내부의 소수성 부분은 세포 안과 밖의 물질들을 선별적으로 통과시키는 기능이 수행되는 장소를 제공한다.
7. DNA가 복제되어 동일한 DNA가 생성될 수 있는 구조적인 근거는 무엇인가?
→ 2개의 polydeoxyribonucleotide가 반대방향으로 정렬되어 있으면서 상보적인 염기끼리 결합되어 있는 것이 원인이다. DNA가 복제될 때에는 2개의 polydeoxyribonucleotide가닥이 풀리고 각 염기에 상보적인 염기를 가지는 deoxyribonucleotide들이 결합하여 새로운 polydeoxyribonucleotide가 형성되어 새로운 DNA가 형성되기 때문에 생산되는 DNA는 원래의 DNA와 동일하다.
8. tRNA가 mRNA가 전사해 온 유전정보에 따라 적절한 아미노산을 mRNA로 운반하여 결합시킬 수 있는 원인은 무엇인가?
→ tRNA의 안티코돈이 mRNA상의 해당하는 코돈의 ribonucleotide 염기에 대해 상보적인 염기로 구성된 ribonucleotide로 구성되어 있고, 안티코돈의 구조에 따라 특별한 아미노산이 tRNA에 결합될 수 있다. 그러므로 mRNA의 구조에 근거하여 아미노산이 mRNA로 운반되는 것이다.
1. 사람, 닭, 돼지가 섬유소를 영양소로 이용할 수 없는 이유와 관련이 있는 것은?
해설 섬유소는 β -D-glucose 간의 β (1→4) glycoside결합으로 구성되어 있는데, 사람, 닭, 돼지
는 이 결합을 분해하는 cellulase를 분비하지 않는다.
2. 구상단백질의 생물학적 기능을 결정하는 가장 중요한 요인은?
해설 단백질의 구조적 특성과 기능은 유전정보가 발현된 아미노산 순서와 아미노산 구성이 가장 중요한 근거이다.
3. 다음은 극성지질과 관련한 내용이다. 맞는 것은?
해설 극성지질은 세포막에 이중층(bilayer)을 형성하여 친수성 부위는 세포 밖, 세포 내부로 향하고 소수성 부위는 세포막 내부에 존재하면서 물질의 출입을 선택적으로 조절할 수 있는 조건을 제공함으로써 물질의 선택적 통과에 기여한다. 중성지방은 지방산의 종류에 관계없이 극성이 없다. 에너지 저장물질은 중성지방이다. 유연성이 나쁜 지질은 스테로이드계 지질이다.
4. mRNA가 DNA의 유전정보를 전사할 수 있는 근거는 무엇인가?
해설 DNA상의 유전정보가 발현되어야 할 부위의 각 deoxyribonucleotide에 상보적인 염기를 가지는 ribonucleotide가 결합하여 mRNA가 합성되기 때문에 mRNA는 DNA의 유전정보를 정확하게 전사할 수 있다.
5. 지용성 비타민과 관련한 내용으로 맞는 것은?
해설 지용성 비타민은 비타민 A, D, E, K로서 이들은 isoprene 단위로 구성되어 있어 구조적으로 공통점이 있다. 지용성 비타민은 몸에 축적되기 때문에 매일 먹지 않아도 상당한 기간동안 결핍되지 않는다.
<생체물질>
단당류 : 작용기에 따라 알도오스(알데하이드기), 케토오스(케톤기)로 분류, glucose
피셔 투영식 : 쇄상구조
하워드 투영식 : 고리구조
chair형 : 탄소 간의 결합각 109.5°이기 때문
대장체 : D / L형
anomer : α / β형
이당류 : 말토오스, 셀로비오스, 락토오스, 설탕
말토오스 : α-D-글루코오스 α(1→4) 글루코시드결합
셀로비오스 : β-D-글루코오스 β(1→4) 글루코시드결합
락토오스 : β-D-글루코오스 β(1→4) 글루코시드결합
설탕(sucrose) : α-D-글루코오스와 β-D-글루코오스가 아노미 탄소끼리 결합, 환원성 없음.
다당류 : 저장 다당류 - 녹말, 글리코겐)\
구조 다당류 – 섬유소, 키틴, 펩티도글라칸
녹말 : 아밀로오스와 아밀로펙틴 함께 존재, 과립상태 존재, 삼투압 증가 없이 대량 저장 가능, 하이드록시기가 구조 외부에 존재하기 때문에 물과 잘 어울려 현탁한다.
아밀로오스 : α-D-글루코오스 α(1→4) 글루코시드결합, 분자량 수십 개~수천 개
아밀로펙틴 : 아밀로오스에 α-D-글루코오스 α(1→6) 글루코시드결합에 의한 곁가지
글리코겐 : 녹말과 유사, 분자량 수백만
섬유소 : β-D-글루코오스 β(1→4) 글루코시드결합, 쇄상구조, 직석상의 구조, 인접한 섬유소간 수소결합, 하이드록시기가 구조 내부에 있어 물과 잘 어울리지 않아 현탁 되지 않음.
키틴 : N-acetyl-글루코오스 β(1→4) 글루코시드결합
펩티도글리칸 : 미생물의 세포벽 구성
단백질 : R부위가 단백질의 특성에 영향을 미친다.
아미노산 : 비극성, 극성, 염기성(양전하), 산성(음전하)
섬유상단백질 : 2차구조만으로 구성된 단백질, 보호기능(털, 깃털), 운동기능(myosin, actin)
구상단백질 : 3차구조를 형성하는 단백질, 생리적(효소, 호르몬)기능, 방어(면역)기능, 운반(헤모글로빈)기능, 아미노산의 구성 및 결합 순서가 기능을 결정
샤페론 : 단백질의 바른 3차구조를 도움.
도메인 혹은 로브 : 구상단백질에 독립된 3차구조가 여려 개 존재
단백질 3차구조를 가능하게 하고 안정하게 하는 요소 : 이온결합, 수소결합, 소수성 결합(3차구조 내부), 쌍극자-쌍극자 힘, 이황화 결합-매우 안정,
지질 : 중성지방, 극성지질, 스테로이드, 왁스
중성지방 : 지방산과 글리세롤의 ester, 에너지 저장물질(소수성→작은 부피), 충격완화, 체온유지, 필수지방산의 공급, 대부분 3개의 지방산, 대부분 복합지방
포화지방 : 동물성, cis형 구조, 밀착, 인력이 강함
불포화지방 : 식물성, trans형 구조, 성긴 구조, 인력이 약함.
극성지방 : 인지질과 스핑고지질, 세포막이 물질들을 선택적으로 통과시키는 기능
스테로이드계 지질 : 동맥경화의 원인, 담즙산, 성호르몬 등의 구성 성분.
왁스 : 분자량이 매우 큼. 실온에서 고체, 물이 묻어서는 안되는 생물체의 부위에 존재하여 생물체 보호
핵산
비타민 : 지용성(A, D, E, K, 이소프렌을 구성 성분으로), 수용성(B, C)
A : 시각 기능
D : 칼슘과 인의 대사
E : 세포막 지방 산화 방지
K : 혈액응고에 기여
B : 조효소의 구성성분이 되어 효소의 활성에 기여
C : 고등동물의 결합조직의 성분인 4-히드록시프롤린의 합성반응의 조효소로 작용, 열에 약함.
물 : ① 산소-음극성, 수소-양극성
② 양극성, 극성을 가지는 물질 및 이온성 물질을 용해시키는 용매로서의 성질 가짐.
③ 산성 : Ⓐ (H+) > (OH¯) Ⓑ (H+) > 10¯7M, (OH¯) < 10¯7 M
완충용액 : 체내에서 일어날 반응이 일정,지속적으로 진행되야하기 땜에 체액의 ph가 일정하게 유지되야함.
C-탄소
① 탄소들이 결합하여 형성된 탄소골격이 유기화합물의 중심(안정성, 다양성)
② 전기음성도가 2.5로 중간 : 여러 원소와 전자 잃거나 빼앗아 오지 않으면서 공유결합을 함
③ 공유결합은 젤 강한 화학결합이기 때문에 유기화합물은 화학적으로 매우 안정됨
시그마결합보다 파이 결합은 결합에너지가 낮으며 반응성이 크다
~ 파이결합은 시그마결합과 달리 두 탄소의 핵을 연결하는 축상에 분포하지 않고 핵에서 보다 멀리 분포하므로
결합전자와 핵 사이의 정전기적 인력이 약하다.
히드록시기=알코올기
① 알코올 히드록시기의 산소-음극, 수소-양극 띠고있어 탄소 수가 5개 이하인 알코올은 물에 잘 용해한다.
② 포도당은 분자내에 히드록시기 5개 있어 물에 대단히 잘 용해됨.
자연계에 존재하는 대부분의 탄수화물은 D-형
거울상 이성질체들은 물리적·화학적 특성이 동일하지만 효소가 거울상 이성질체를 구분하기 때문에 기능 다름
① 반추동물 : 섬유소의 ß(1→4) glycoside 결합
② 단위동물 : 녹말의 a(1→4) glycoside 결합
단백질이 유리 카르복시기를 가지도록 하는 아미노산 : 아스파르트산과 글루탐산
▪글루탐산 : 탄소골격에 아미노기 전달→새로운 아미노산을 합성→모든 아미노산 아미노기 공급(트립토판 제외)
섬유상단백질 : 2차 구조(a-나선,ß-형)만을 가지고 있는 단백질
▪ 친수성부위→분자내부에 존재→물에 젖지않아 동물체의 몸을 보호하는 기능
구상단백질 : ① 3차구조 단백질, 특별한 생물학적 기능을 가지는 단백질
② 1차 <아미노산 구성 및 결합순서>가 원인이지만 , 3차구조 형성에 <분자 샤페론>이 도와줌.
불포화지방산의 불포화결합 부위는 <cis> 구조를 하기 때문에 불포화결합 부위에서 구부러진다.
그러므로 불포화지방산들이 모여있으면 성긴 구조를 하여 지방산 간의 인력이 약하기 때문에 융점이 낮다.
인지질, 스핑고지질 : 극성지질로서 물질의 세포출입을 선택적으로 조절한다.
극성지질 :① 친수성 부위→세포 밖의 체액과, 세포 안쪽의 시토졸과 접해있음
② 소수성 부위→세포막 내부에 있고 소수성 성분이 세포막 구성분으로 안정하게 존재하도록 하고,
물질들이 세포막을 선택적으로 통과시키는 조절기능이 가능한 환경을 제공
DNA 구성염기 : 아데닌(adenine), 구아닌(guanine), 시토신(cytosine), 티민(thymine)
RNA 구성염기 : “ , 우라실(uracil)
상보적 염기 : 아데닌, 티민(A=T) / 구아닌, 시토신(C≡G)
비타민 C: 산화하면서 전환됨. 산화반응은 온도가 높을수록 빨리 진행. 가열에 의해 쉽게 파괴.
녹말, 글리코겐 : 히드록시기가 외부로 노출되어 있어 고도로 수화된 상태로 존재,
글루코오스가 다당류가 전환됨으로써 세포 내 삽투압이 증가하는 문제 없이 글루코오스 대량 저장 가능
tRNA의 anticondon(안티코돈)은 운반할 아미노산에 해당하는 유전정보
세포 : 대사반응 위해 물질 출입속도가 적절해야 하기 때문에 크기가 매우 작다.
식물세포 : 세포벽, 엽록체, 글리옥시솜, 액포 / 동물세포 : 리소좀
▪ 글리옥시솜 : 식물의 종자에 존재, 지방산 ß-산화반응이 일어남
① 바이러스: DNA와 RNA중 한 가지와 극소수 효소 가지고 있기 때문에 스스로 번식못하고, 단백질 합성 못함.
② 동물세포, 세균 : DNA, RNA 둘 다 가지고 있다.
미토콘드리아(진핵세포) : 에너지 생산
동물세포에서는 지방산이 에너지원으로 이용되는 대사인 ß산화체계가 미토콘드리아 기질에 존재
(요약) 생체물질
⦁단위동물은 녹말을 분해할 수 있는 α-아밀라아제는 분비하지만 섬유소를 분해하는 셀롤라아제는 분비하지 못하기 때문에 섬유소는 영양소로 이용하지 못한다. 반추동물은 반추위에 존재하는 미생물이 셀로라아제를 분비하여 섬유소를 분해하기 때문에 섬유소를 영양소로 이용할 수 있다.
⦁우유를 과하게 마시면 설사를 하는 이유는 소장에서 우유의 유당을 분해할 수 있는 락타아제가 부족하게 분비되는 것이 원인이다. 분해되지 않은 유당이 대장으로 이행하면 대장의 삼투압이 증가하여 대장 내용물의 수분 함량이 비정상적으로 증가하면 설사를 하게 된다.
⦁시스틴 두 분자가 근접하면 이활화 결합을 형성한다. 이황화 결합은 공유결합으로서 단백질의 3차구조 유지에 가장 강하게 기여하는 화학결합이다. 그러므로 시스틴 함량이 높으면 3차구조에서 서로 접근하는 경우 이활화 결합을 형성할 가능성이 크기 때문에 단백질의 3차구조가 대단히 안정하다.
⦁단백질의 특성과 기능의 원인은 폴리펩티드상의 아미노산 구성과 순서인데 이는 해당 단백질의 유전자의 유전정보가 근거가 되는 것이다. 그러므로 단백질의 특성과 기능은 유전자의 유전정보가 원인이다.
⦁중성지방은 탄수화물과 단백질보다 산화가 덜 되어 에너지생산 대사에서 에너지를 더 많이 생산할 뿐만 아니라 소수성이기 때문에 체내에서 가급적 수분과 접촉을 적게 하기 위해 작은 부피를 유지하고자 하므로 적은 용적을 차지한다.
⦁극성지질의 친수성 부위가 세포막의 밖과 안쪽으로 향하고 소수성 부윈ㄴ 세포막의 중심부에 향하여 위치함으로써 세포 밖과 세포 안의 물과 접해 있으므로 세포 밖의 체액과 세포 안의 세포액의 물에 용해되어 있는 물질이 세포막으로 접근할 수 있도록 한다. 세포막 내부의 소수성 부분은 세포 안과 밖의 물질들을 선별적으로 통과시키는 기능이 수행되는 장소를 제공한다.
⦁2개의 polydeoxyribonucleotide가 반대방향으로 정열되어 있으면서 상보적인 염기끼리 결합되어 있는 것이 원인이다. DNA가 복재될 때에는 2개의 polydeoxyribonucleotide 가단이 풀리고 각 염기에 상보적인 염기를 가지는 deoxyribonucleotide들이 결합하여 새로운 polydeoxyribonucleotide가 형성되어 새로운 DNA가 형성되기 때문에 생산되는 DNA는 원래의 DNA와 동일하다.
⦁tRNA의 안티코돈이 mRNA상의 해당하는 코돈의 ribonucleotide 염기에 대해 상보적인 염기로 구성된 ribonucleotide로 구성되어 있고, 안티코돈의 구조에 따라 특별한 아미노산이 tRNA에 결합될 수 있다. 그러므로 mRNA의 구조에 근거하여 아미노산이 mRNA로 운반되는 것이다.
⦁섬유소는 β-D-glucose 간의 β(1→4) glycoside결합으로 구성되어 있는데, 사람, 닭, 돼지는 이 결합을 분해하는 cellulase를 분비하지 않는다.
⦁단백질의 구조적 특성과 기능은 유전정보가 발현된 아미노산 순서와 아미노산 구성이 가장 중요한 근거이다.
⦁극성지질은 세포막에 이중층(bilayer)을 형성하여 친수성 부위는 세포 밖, 세포 내부로 향하고 소수성 부위는 세포막 내부에 존재하면서 물질의 출입을 선택적으로 조절할 수 있는 조건을 제공함으로써 물질의 선택적 통과에 기여한다. 중성지방은 지방산의 종류에 관계없이 극성이 없다. 에너지 저장물질은 중성지방이다. 유연성이 나쁜 지질은 스테로이드계 지질이다.
⦁DNA상의 유전정보가 발현되어야 할 부위의 각 deoxyribonucleotide에 상보적인 염기를 가지는 ribonucleotide가 결합하여 mRNA가 합성되기 때문에 mRNA는 DNA의 유전정보를 정확하게 전사할 수 있다.
⦁지용성 비타민은 비타민 A, D, E, K로서 이들은 isoprene 단위로 구성되어 있어 구조적으로 공통점이 있다.
지용성 비타민은 몸에 축적되기 때문에 매일 먹지 않아도 상당한 기간동안 결핍되지 않는다.
[인강연습문제]
1. 설탕은 환원당이 아닌 이유는 무엇인가? ☞설탕을 구성하는 glucose의 알데히드기와 fructose의 케톤기가 결합에 참여하고 있어 환원성의 원인이 되는 작용기들이 화학반응에 참여할 수 없는 구조를 가지고 있기 때문이다.
2.식물과 동물이 에너지를 다당류의 형태로 저장해야 하는 이유는 무엇인가?
☞ 세포내 물질의 몰랄농도가 높으면 삼투압이 증가하여 세포외부로부터 물이 세포안으로 이동하여 세포가 형태를 유지할 수 없다. 다당류는 분자량이 크기 때문에 몰랄농도를 낮게 유지하면서 세포에 존재할 수 있다.
3.아미노산의 R 원자단이 아미노산 특성에 매우 중요한 이유는 무엇인가?
☞ α-탄소의 아미노기와 카르복시기는 다른 아미노산과 펩티드 결합을 형성하므로 단백질에서 유리상태로 존재하지 않는다. 그러나 R 부위는 결합에 참여하고 있지 않기 때문에 단백질의 특성에 직접 기여한다.
4.단백질이 유리 카르복시기를 가지도록 하는 아미노산을 드시오
☞ 아스파르트산, 글루탐산.
5.2차구조의 섬유상단백질이 생물체를 보호하는 기능을 가지고 있는 이유는 무엇인가?
☞ 소수성 부위가 외부로 노출되어 있어 물에 젖지 않기 때문이다.
6.불포화지방산 함량이 높은 지방의 융점이 낮은 원인은 무엇인가?
☞ 불포화결합부위의 구조가 시스형이기 때문이다. 시스형의 구조는 지방 분자들이 집단을 형성할 때 분자간 거리가 가깝지 못하여 분자간 인력이 약하게 작용한다. 분자 간 인력이 약하면 운동에 필요한 에너지가 작게 되고 이는 낮은 온도의 적은 에너지에서도 운동성이 있어 액체상태로 존재할 수 있다.
7.극성지질이 세포막에서 중요한 기능을 담당할 수 있는 이유는 무엇인가?
☞ 세포막은 세포안팎으로 세포가 필요한 물질, 세포가 필요하지 않은 물질을 구분하여 통과시키는 기능이 있다. 세포막을 통과해야하는 물질의 종류는 대단히 많아 특성도 다양한데 세포막은 이들을 분별하여 통과시킨다. 이러한 분별기능은 세포막을 구성하는 여러 가지 성분이며 그러한 성분들은 세포막 내부의 소수성 환경에서 역할을 수행한다. 극성지질은 극성부위는 세포막 양쪽 외부에 존재하여 세포안과 세포막의 수분에 접해 있고 소수성 부위는 세포 막 내부의 소수성 지역에 존재하면서세포막 내부가 소수성 환경을 유지하게 하면서 세포막이 세포내부와 외부의 물과 안정하게 접촉할 수 있도록 하는 기능을 가진다.
8.DNA와 RNA의 구성성분의 차이를 지적하시오.
※ DNA의 구성은 deoxyribose, 인산, adenine, thymine, guanine, cytosine이다. RNA의 구성은 ribose, 인산, adenine, guanine, cytosine, uracil이다. 그러므로 DNA가 RNA와 다른 구성은 deoxyribose와 thymine이며, RNA가 DNA와 다른 구성은ribose와 uracil 이다.
9. tRNA가 mRNA에 전사된 유전정보에 따라 아미노산을 ribosome에 운반할 수 있는 구조적 근거는 무엇인가?
☞ 안티코돈의 구조이다. 안티코돈의 염기배열이 mRNA의 상보적 염기로 구성되어 있고, 안티코돈의 구조와 아미노산 결합부위의 구조가 연계되어 있어 mRNA가 지시하는 아미노산을 tRNA가 운반한다.
10. 비타민C가 열에 잘 파괴되는 이유는 무엇인가?
☞ 비타민 C는 산화되면 활성을 잃기 때문이다. 산화반응은 화학반응의 일종으로서 온도가 높으면 반응 속도가 높아진다. 그러므로 가열하면 비타민 C가 공기 중에 존재하는 산소와 반응을 잘하여 활성이 소실된다.
11. 반추동물이 단위동물이 소화할 수 없는 섬유소(cellulose)를 반추위내 미생물의 작용에 의해 효율적으로 이용할 수 있는 것은 다당류의 어떤 구조의 차이에 기인하는 것인가?
※섬유소는 β-D-glucose들이 β1-4 glycoside결합에 의해 구성된 다당류로서 단위동물이 분비하는 녹말 분해 소화효소(amylase)가 분해할 수 있는 α1-4 glycoside 혹은 α1-6 glycoside 결합과 다른 다당류의 구조를 가지기 때문이다.
※ 부족하지만 글의 내용이 도움이 조금이라도 되셨다면, 단 1초만 부탁드려도 될까요? 로그인이 필요없는 하트♥(공감) 눌러서 블로그 운영에 힘을 부탁드립니다. 그럼 오늘도 행복한 하루 되십시오^^
'농업생물화학' 카테고리의 다른 글
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 8. 효소반응 (9) | 2022.11.26 |
|---|---|
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 7. 세포 (7) | 2022.11.25 |
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 5. 유기화학 (4) | 2022.11.23 |
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 4. 수용액의 화학 (8) | 2022.11.22 |
| 농업직, 농학과, 화학, 방통대 등 농업생물화학 핵심 요점 정리 3. 화학반응 (3) | 2022.11.21 |